Xlorning fizik va kimyoviy xossalari qisqacha. Tabiatdagi xlor. Xlordan sanoat maqsadlarida foydalanish
Tabiatda xlor gazsimon holatda va faqat boshqa gazlar bilan birikmalar shaklida bo'ladi. Oddiy sharoitlarda u yashil rangdagi zaharli, o'yuvchi gazdir. Havodan ko'ra ko'proq vaznga ega. Shirin hidi bor. Xlor molekulasi ikkita atomdan iborat. Sokin holatda u yonmaydi, lekin yuqori haroratda u vodorod bilan o'zaro ta'sir qiladi, shundan keyin portlash mumkin. Natijada fosgen gazi ajralib chiqadi. Juda zaharli. Shunday qilib, havodagi past konsentratsiyalarda ham (1 dm 3 uchun 0,001 mg) o'limga olib kelishi mumkin. xlor havodan og'irroq ekanligini ta'kidlaydi, shuning uchun u har doim polga yaqin joyda sarg'ish-yashil tuman shaklida bo'ladi.
Tarixiy faktlar
Amaliyotda birinchi marta bu moddani 1774 yilda K.Sheeley xlorid kislota va piroluzitni birlashtirib olgan. Biroq, faqat 1810 yilda P. Davy xlorni tavsiflab, uning alohida kimyoviy element ekanligini aniqlay oldi.
Shunisi e'tiborga loyiqki, u 1772 yilda xlor va vodorod birikmasi bo'lgan vodorod xloridni olishga muvaffaq bo'ldi, ammo kimyogar bu ikki elementni ajrata olmadi.
Xlorning kimyoviy xossalari
Xlor davriy sistemaning VII guruhining asosiy kichik guruhining kimyoviy elementidir. U uchinchi davrda va atom raqami 17 (atom yadrosida 17 proton) ga ega. Kimyoviy faol metall bo'lmagan. Cl harflari bilan belgilanadi.
Bu rangga ega bo'lmagan, ammo o'tkir, o'tkir hidga ega bo'lgan gazlarning odatiy vakili. Odatda toksik. Barcha halogenlar suvda yaxshi suyultiriladi. Nam havo ta'sirida ular chekishni boshlaydilar.
Cl atomining tashqi elektron konfiguratsiyasi 3s2Zr5. Shuning uchun birikmalarda kimyoviy element -1, +1, +3, +4, +5, +6 va +7 oksidlanish darajasini ko'rsatadi. Atomning kovalent radiusi 0,96 Å, Cl-ning ion radiusi 1,83 Å, atom elektronning yaqinligi 3,65 eV, ionlanish darajasi 12,87 eV.
Yuqorida aytib o'tilganidek, xlor juda faol nometall bo'lib, u deyarli har qanday metallar (ba'zi hollarda issiqlik yoki namlik yordamida, bromni almashtiruvchi) va metall bo'lmaganlar bilan birikmalar hosil qilish imkonini beradi. Kukun shaklida faqat yuqori harorat ta'sirida metallar bilan reaksiyaga kirishadi.
Maksimal yonish harorati 2250 ° S. Kislorod bilan oksidlar, gipoxloritlar, xloritlar va xloratlar hosil qilishi mumkin. Kislorodni o'z ichiga olgan barcha birikmalar oksidlovchi moddalar bilan o'zaro ta'sirlashganda portlovchi holatga keladi. Shuni ta'kidlash kerakki, ular o'zboshimchalik bilan portlashi mumkin, xloratlar esa har qanday tashabbuskorlar ta'sirida portlaydi.
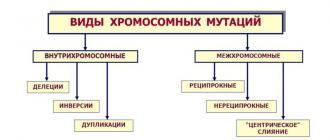
Xlorning davriy tizimdagi o'rni bo'yicha xususiyatlari:
Oddiy modda;
. davriy jadvalning o'n ettinchi guruhi elementi;
. uchinchi qatorning uchinchi davri;
. asosiy kichik guruhning ettinchi guruhi;
. atom raqami 17;
. Cl belgisi bilan belgilanadi;
. reaktiv metall bo'lmagan;
. halogen guruhiga kiradi;
. me'yorga yaqin sharoitda bu o'tkir hidli sarg'ish-yashil rangdagi zaharli gazdir;
. xlor molekulasi 2 atomga ega (formula Cl 2).

Xlorning fizik xususiyatlari:
Qaynash nuqtasi: -34,04 °C;
. erish nuqtasi: -101,5 ° C;
. gazsimon holatdagi zichlik - 3,214 g/l;
. suyuq xlorning zichligi (qaynatish davrida) - 1,537 g / sm3;
. qattiq xlorning zichligi - 1,9 g / sm 3;
. o'ziga xos hajm - 1,745 x 10 -3 l / g.
Xlor: harorat o'zgarishining xususiyatlari
Gaz holatida u osonlik bilan suyultirishga moyil. 8 atmosfera bosimi va 20 ° S haroratda yashil-sariq suyuqlikka o'xshaydi. Juda yuqori korroziy xususiyatlarga ega. Amaliyot shuni ko'rsatadiki, bu kimyoviy element yuqori bosim ostida suyuqlik holatini kritik haroratgacha (143 ° C) ushlab turishi mumkin.
Agar u -32 ° C haroratgacha sovutilsa, u atmosfera bosimidan qat'iy nazar suyuqlikka o'tadi. Haroratning yanada pasayishi bilan kristallanish sodir bo'ladi (-101 ° C da).

Tabiatdagi xlor
Yer qobig'ida faqat 0,017% xlor mavjud. Asosiy qismi vulqon gazlarida uchraydi. Yuqorida aytib o'tilganidek, modda katta kimyoviy faollikka ega, buning natijasida tabiatda boshqa elementlar bilan birikmalarda topiladi. Biroq, ko'plab minerallar tarkibida xlor mavjud. Elementning xarakteristikalari yuzga yaqin turli xil minerallarni hosil qilish imkonini beradi. Qoida tariqasida, bu metall xloridlardir.
Bundan tashqari, uning katta miqdori Jahon okeanida joylashgan - deyarli 2%. Buning sababi shundaki, xloridlar juda faol eriydi va daryolar va dengizlar orqali tashiladi. Teskari jarayon ham mumkin. Xlor yana qirg'oqqa yuviladi, keyin esa shamol uni atrofdagi hududga olib yuradi. Shuning uchun uning eng katta kontsentratsiyasi qirg'oq zonalarida kuzatiladi. Sayyoramizning qurg'oqchil hududlarida biz ko'rib chiqayotgan gaz suvning bug'lanishi orqali hosil bo'ladi, buning natijasida sho'r botqoqlar paydo bo'ladi. Dunyoda har yili 100 million tonnaga yaqin ushbu modda qazib olinadi. Biroq, bu ajablanarli emas, chunki xlor o'z ichiga olgan ko'plab konlar mavjud. Biroq, uning xususiyatlari ko'p jihatdan geografik joylashuviga bog'liq.
Xlor ishlab chiqarish usullari
Bugungi kunda xlor ishlab chiqarishning bir qancha usullari mavjud bo'lib, ulardan eng keng tarqalganlari quyidagilardir:
1. Diafragma. Bu eng oddiy va eng arzon. Diafragma elektrolizidagi sho'r eritma anod bo'shlig'iga kiradi. Keyin u po'lat katod panjarasi orqali diafragma ichiga oqadi. Uning tarkibida oz miqdorda polimer tolalari mavjud. Ushbu qurilmaning muhim xususiyati qarama-qarshi oqimdir. U anod bo'shlig'idan katod bo'shlig'iga yo'naltiriladi, bu xlor va ishqorlarni alohida olish imkonini beradi.
2. Membrana. Eng energiya tejamkor, ammo tashkilotda amalga oshirish qiyin. Diafragmaga o'xshash. Farqi shundaki, anod va katod bo'shliqlari membrana bilan to'liq ajratilgan. Shuning uchun chiqish ikkita alohida oqimdir.
Shuni ta'kidlash kerakki, kimyoviy xususiyatlar bu usullar bilan olingan element (xlor) har xil bo'ladi. Membran usuli ko'proq "toza" deb hisoblanadi.
3. Suyuq katod bilan simob usuli. Boshqa texnologiyalar bilan taqqoslaganda, bu variant sizga eng toza xlorni olish imkonini beradi.
O'rnatishning asosiy diagrammasi elektrolizator va o'zaro bog'langan nasos va amalgam parchalanuvchidan iborat. Stol tuzining eritmasi bilan birga pompalanadigan simob katod, uglerod yoki grafit elektrodlari esa anod bo'lib xizmat qiladi. O'rnatishning ishlash printsipi quyidagicha: xlor elektrolitdan chiqariladi, u elektrolizatordan anolit bilan birga chiqariladi. Nopokliklar va qoldiq xlor ikkinchisidan chiqariladi, galit bilan to'yintiriladi va elektroliz uchun qaytariladi.
Sanoat xavfsizligi talablari va foydasiz ishlab chiqarish suyuq katodni qattiq bilan almashtirishga olib keldi.

Xlordan sanoat maqsadlarida foydalanish
Xlorning xossalari uni sanoatda faol ishlatishga imkon beradi. Ushbu kimyoviy element yordamida turli xil (vinilxlorid, xlor kauchuk va boshqalar) dori vositalari va dezinfektsiyalash vositalari olinadi. Ammo sanoatda eng katta joy - bu xlorid kislotasi va ohak ishlab chiqarish.
Ichimlik suvini tozalash usullari keng qo'llaniladi. Bugungi kunda ular bu usuldan uzoqlashishga, uni ozonlash bilan almashtirishga harakat qilmoqdalar, chunki biz ko'rib chiqayotgan modda inson tanasiga salbiy ta'sir qiladi va xlorli suv quvurlarni buzadi. Buning sababi, erkin holatda Cl poliolefinlardan tayyorlangan quvurlarga zararli ta'sir ko'rsatadi. Biroq, aksariyat mamlakatlar xlorlash usulini afzal ko'radi.

Xlor metallurgiyada ham qo'llaniladi. Uning yordami bilan bir qator nodir metallar (niobiy, tantal, titan) olinadi. Kimyo sanoatida begona o'tlarni nazorat qilish uchun turli xil organik xlorli birikmalar faol qo'llaniladi va boshqa qishloq xo'jaligi maqsadlarida ham oqartiruvchi sifatida ishlatiladi;
Kimyoviy tuzilishi tufayli xlor ko'pchilik organik va noorganik bo'yoqlarni yo'q qiladi. Bunga ularni butunlay oqartirish orqali erishiladi. Bu natija faqat suv ishtirokida mumkin, chunki xlor parchalanishidan keyin hosil bo'lgan rang o'zgarishi jarayoni sodir bo'ladi: Cl 2 + H 2 O → HCl + HClO → 2HCl + O. Bu usul bir-ikkita qo'llanilishini topdi. asrlar oldin va hozir ham mashhur.
Ushbu moddadan organoklorli insektitsidlarni ishlab chiqarish uchun foydalanish juda mashhur. Ushbu qishloq xo'jaligi mahsulotlari o'simliklarni buzilmagan holda qoldirish bilan birga zararli organizmlarni o'ldiradi. Sayyorada ishlab chiqarilgan barcha xlorning muhim qismi qishloq xo'jaligi ehtiyojlari uchun ishlatiladi.

U plastik birikmalar va kauchuk ishlab chiqarishda ham qo'llaniladi. Ulardan simli izolyatsiyalash, ofis jihozlari, jihozlar, maishiy texnika uchun korpuslar va boshqalar ishlab chiqariladi. Shu tarzda olingan kauchuklar odamlar uchun zararli degan fikr bor, ammo bu fan tomonidan tasdiqlanmagan.
Shunisi e'tiborga loyiqki, xlor (moddaning xarakteristikalari biz tomonidan avvalroq batafsil tavsiflangan) va uning hosilalari, masalan, xantal gazi va fosgen, kimyoviy urush vositalarini ishlab chiqarish uchun harbiy maqsadlarda ham qo'llaniladi.
Xlor metall bo'lmaganlarning ko'zga ko'ringan vakili sifatida
Metall bo'lmaganlar - gazlar va suyuqliklarni o'z ichiga olgan oddiy moddalar. Ko'pgina hollarda ular elektr tokini metallarga qaraganda yomonroq o'tkazadilar va fizik va mexanik xususiyatlarda sezilarli farqlarga ega. Yuqori darajadagi ionlanish yordamida ular kovalent kimyoviy birikmalar hosil qilishlari mumkin. Quyida misol sifatida xlor yordamida metall bo'lmaganlarning tavsifini beramiz.
Yuqorida aytib o'tilganidek, bu kimyoviy element gazdir. Oddiy sharoitlarda u metallarnikiga o'xshash xususiyatlarga to'liq ega emas. Tashqi yordamisiz u kislorod, azot, uglerod va boshqalar bilan o'zaro ta'sir qila olmaydi, oddiy moddalar va ba'zi murakkab moddalar bilan bog'langan holda o'zining oksidlovchi xususiyatlarini namoyon qiladi. Bu halogen bo'lib, uning kimyoviy xossalarida aniq namoyon bo'ladi. Galogenlarning boshqa vakillari (brom, astatin, yod) bilan birgalikda ularni siqib chiqaradi. Gaz holatida xlor (uning xarakteristikalari buni bevosita tasdiqlaydi) juda eriydi. Ajoyib dezinfektsiyalovchi vositadir. U faqat tirik organizmlarni o'ldiradi, bu esa uni qishloq xo'jaligi va tibbiyotda ajralmas qiladi.
Zaharli modda sifatida foydalaning
Xlor atomining xususiyatlari uni zaharli vosita sifatida ishlatishga imkon beradi. Gaz birinchi marta 1915-yil 22-aprelda Birinchi jahon urushi paytida Germaniya tomonidan qo'llanilgan, buning natijasida 15 mingga yaqin odam halok bo'lgan. Ayni paytda u qo'llanilmaydi.
Kimyoviy elementning asfiksiya sifatida qisqacha tavsifini beraylik. Bo'g'ilish orqali inson tanasiga ta'sir qiladi. Avval yuqori nafas yo'llarini va ko'zning shilliq qavatini bezovta qiladi. Qattiq yo'tal bo'g'ilish xurujlari bilan boshlanadi. Bundan tashqari, o'pkaga kirib, gaz o'pka to'qimasini korroziyaga olib keladi, bu esa shish paydo bo'lishiga olib keladi. Muhim! Xlor tez ta'sir qiluvchi moddadir.
Havodagi kontsentratsiyaga qarab, alomatlar o'zgaradi. Past darajada, odam ko'zning shilliq qavatining qizarishi va engil nafas qisilishi bilan duch keladi. Atmosferadagi 1,5-2 g / m 3 miqdori ko'krak qafasidagi og'irlik va o'tkir his-tuyg'ularni, yuqori nafas yo'llarida o'tkir og'riqni keltirib chiqaradi. Vaziyat kuchli lakrimatsiya bilan hamroh bo'lishi mumkin. Xlorning bunday konsentratsiyasi bo'lgan xonada 10-15 daqiqadan so'ng o'pkaning kuchli kuyishi va o'lim sodir bo'ladi. Zichroq konsentratsiyalarda, yuqori nafas yo'llarining falajidan bir daqiqa ichida o'lim mumkin.

Xlor organizmlar va o'simliklar hayotida
Xlor deyarli barcha tirik organizmlarda mavjud. O'ziga xosligi shundaki, u sof shaklda emas, balki birikmalar shaklida mavjud.
Hayvon va odam organizmlarida xlor ionlari osmotik tenglikni saqlaydi. Buning sababi, ular membrana hujayralariga kirish uchun eng mos radiusga ega. Kaliy ionlari bilan birga Cl suv-tuz balansini tartibga soladi. Ichakda xlor ionlari me'da shirasining proteolitik fermentlarining ta'siri uchun qulay muhit yaratadi. Xlor kanallari tanamizning ko'plab hujayralarida mavjud. Ular orqali suyuqliklarning hujayralararo almashinuvi sodir bo'ladi va hujayraning pH darajasi saqlanadi. Tanadagi ushbu elementning umumiy hajmining taxminan 85% hujayralararo bo'shliqda joylashgan. Uretra orqali tanadan chiqariladi. Emizish davrida ayol tanasi tomonidan ishlab chiqariladi.
Rivojlanishning ushbu bosqichida xlor va uning birikmalari qaysi kasalliklarni qo'zg'atayotganini aniq aytish qiyin. Buning sababi bu sohada tadqiqotlarning kamligidir.
Xlor ionlari o'simlik hujayralarida ham mavjud. U energiya almashinuvida faol ishtirok etadi. Ushbu elementsiz fotosintez jarayoni mumkin emas. Uning yordami bilan ildizlar kerakli moddalarni faol ravishda o'zlashtiradi. Ammo o'simliklardagi xlorning yuqori konsentratsiyasi zararli ta'sir ko'rsatishi mumkin (fotosintez jarayonini sekinlashtiradi, rivojlanish va o'sishni to'xtatadi).

Biroq, "do'stlashish" yoki hech bo'lmaganda bu element bilan til topisha olgan flora vakillari bor. Metall bo'lmagan (xlor) xususiyatlarida moddaning tuproqni oksidlash qobiliyati kabi element mavjud. Evolyutsiya jarayonida yuqorida qayd etilgan galofitlar deb ataladigan o'simliklar bu elementning ko'pligi tufayli bo'sh bo'lgan bo'sh sho'r botqoqlarni egallagan. Ular xlor ionlarini o'zlashtiradilar, so'ngra barglar tushishi bilan ulardan xalos bo'lishadi.
Xlorni tashish va saqlash
Xlorni ko'chirish va saqlashning bir necha yo'li mavjud. Elementning xarakteristikalari maxsus yuqori bosimli tsilindrlarni talab qiladi. Bunday idishlarda identifikatsiya belgisi mavjud - vertikal yashil chiziq. Tsilindrlarni har oy yaxshilab yuvish kerak. Xlor uzoq vaqt saqlansa, juda portlovchi cho'kma - azot trixlorid hosil bo'ladi. Barcha xavfsizlik qoidalariga rioya qilmaslik o'z-o'zidan yonish va portlashga olib kelishi mumkin.

Xlorni o'rganish
Kelajakdagi kimyogarlar xlorning xususiyatlarini bilishlari kerak. Rejaga ko‘ra, 9-sinf o‘quvchilari fan bo‘yicha boshlang‘ich bilimlari asosida ushbu modda bilan hatto laboratoriya tajribalarini ham o‘tkazishlari mumkin. Tabiiyki, o'qituvchi xavfsizlik bo'yicha ko'rsatmalar berishga majburdir.
Ish tartibi quyidagicha: siz xlorli kolbani olishingiz va unga kichik metall talaşlarni quyishingiz kerak. Parvoz paytida talaşlar yorqin yorug'lik uchqunlari bilan yonadi va ayni paytda ochiq oq SbCl 3 tutuni paydo bo'ladi. Qalay folga xlorli idishga solinganda, u ham o'z-o'zidan alangalanadi va olovli qor parchalari asta-sekin kolba tubiga tushadi. Ushbu reaksiya jarayonida tutunli suyuqlik hosil bo'ladi - SnCl 4. Idishga temir qo'ziqorin qo'yilganda qizil "tomchilar" paydo bo'ladi va qizil FeCl 3 tutuni paydo bo'ladi.
Amaliy ishlar bilan bir qatorda nazariya ham takrorlanadi. Xususan, davriy jadvaldagi pozitsiyasi bo'yicha xlorning xususiyatlari kabi savol (maqolaning boshida tasvirlangan).

Tajribalar natijasida element organik birikmalarga faol reaksiyaga kirishishi ma'lum bo'ldi. Agar siz ilgari turpentinga namlangan paxta momig'ini xlorli idishga solsangiz, u bir zumda yonib ketadi va kolbadan to'satdan kuyikadi. Natriy sarg'ish olov bilan ajoyib tarzda yonadi va kimyoviy idishning devorlarida tuz kristallari paydo bo'ladi. Talabalar uchun shuni bilish qiziqki, hali yosh kimyogar N. N. Semenov (keyinchalik Nobel mukofoti laureati) bunday tajriba o'tkazgandan so'ng, kolba devorlaridan tuz yig'ib, nonga sepib yeydi. Kimyo to'g'ri chiqdi va olimni tushkunlikka tushirmadi. Kimyogar tomonidan o'tkazilgan tajriba natijasida oddiy osh tuzi haqiqatan ham chiqdi!
U sanoat, qishloq xo'jaligi, dorivor va maishiy ehtiyojlar uchun keng qo'llaniladi. Dunyoda yillik xlor ishlab chiqarish 55,5 million tonnani tashkil qiladi: ushbu moddaning bunday keng tarqalishi tufayli uning oqishi bilan bog'liq baxtsiz hodisalar juda tez-tez uchraydi (ular sanoat ob'ektlarida ham, xlorni tashish paytida ham sodir bo'ladi).
Ko'pincha nafaqat sanoat ob'ekti, balki uning tashqarisidagi joylar ham shikastlanadi (xlorning fizik-kimyoviy xususiyatlari tufayli: u havodan 2,5 baravar og'irroqdir, shuning uchun u pasttekisliklarda to'planadi, suv manbalari ifloslanishga duchor bo'ladi, chunki xlor suvda juda eriydi).
Shu sababli, xlor ishlab chiqaradigan yoki ishlatadigan iqtisodiy ob'ektlar, xlor bilan zaharlanish belgilari, birinchi yordam ko'rsatish ko'nikmalari, shuningdek, ifloslangan hududda ishlatiladigan shaxsiy himoya vositalarini bilish bugungi kunda ayniqsa dolzarbdir.
Xlorni xavfli modda sifatida tekshirishdan, ushbu kimyoviy modda bilan zaharlanish belgilarini aniqlashdan va tibbiy va birinchi yordam nima ekanligini aniqlashdan oldin uning umumiy xususiyatlari va foydalanish sohalari bilan tanishish kerak.
Xlor (yunonchadan - "yashil"). Kimyoviy formula - Cl2 (molekulyar og'irligi - 70,91). Xlor bilan birikma (vodorod xlorid gazi) birinchi marta 1772 yilda D. Pristley tomonidan tayyorlangan. "Sof shaklda" xlor ikki yildan so'ng K.V.
Suyuq xlorning zichligi 1560 kg/m3. U yonmaydi va reaktivdir: yorug'likda yuqori haroratlarda (masalan, yong'in sodir bo'lganda) vodorod bilan o'zaro ta'sir qiladi (portlash), bu esa yanada xavfli gaz - fosgen hosil bo'lishiga olib kelishi mumkin.
Xlor sanoat, fan va ko'pincha kundalik hayotda ko'plab sohalarda qo'llaniladi. Sanoatda xlordan foydalanish sohalarini sanab o'tamiz:
– polivinilxlorid, sintetik kauchuk, plastmassa birikmalar ishlab chiqarishda qo‘llaniladi (bu materiallar linoleum, kiyim-kechak, poyabzal, sim izolatsiyasi va boshqalar ishlab chiqarish uchun ishlatiladi);
– sellyuloza-qog‘oz sanoatida xlor qog‘oz va kartonni oqartirish uchun ishlatiladi (u gazlamalarni oqartirish uchun ham qo‘llaniladi);
– xlororganik insektitsidlar ishlab chiqarishda ishtirok etadi (ekinlardagi zararli hasharotlarni yo‘q qiladigan bu moddalar qishloq xo‘jaligida qo‘llaniladi);
- ichimlik suvini zararsizlantirish (xlorlash) va oqava suvlarni tozalash jarayonida qo'llaniladi;
– bertolet tuzi, dori vositalari, oqartiruvchi moddalar, zaharlar, xlorid kislotasi, metall xloridlarini kimyoviy ishlab chiqarishda keng qo‘llaniladi;
– metallurgiyada sof metallar olish uchun ishlatiladi;
- bu modda quyosh neytrinolarining ko'rsatkichi sifatida ishlatiladi.
Xlor silindrsimon sisternalarda (10...250 m3) va sharsimon (600...2000 m3) rezervuarlarda o‘zining bug‘ bosimida (1,8 MPa gacha) saqlanadi. Oddiy haroratlarda bosim ostida suyultiriladi. Vaqtinchalik saqlash joylari sifatida ishlaydigan konteynerlarda, tsilindrlarda, tanklarda tashiladi.
Xlor, ehtimol, alkimyogarlar tomonidan olingan, ammo uning kashfiyoti va birinchi tadqiqotlari mashhur shved kimyogari Karl Vilgelm Scheele nomi bilan uzviy bog'liqdir. Scheele beshta kimyoviy elementni - bariy va marganetsni (Ioxan Xan bilan birgalikda), molibden, volfram, xlorni va boshqa kimyogarlardan mustaqil ravishda (keyinroq bo'lsa ham) - yana uchtasini: kislorod, vodorod va azotni kashf etdi. Bu yutuqni keyinchalik hech kim kimyogar takrorlay olmadi. Shu bilan birga, Shvetsiya Qirollik Fanlar akademiyasining a'zosi etib saylangan Scheele Köpingda oddiy farmatsevt edi, garchi u yanada sharafli va obro'li lavozimni egallashi mumkin edi. Buyuk Fridrix II ning o'zi, Prussiya qiroli unga Berlin universitetida kimyo professori lavozimini taklif qildi. Bunday jozibali takliflarni rad etib, Scheele dedi: "Men kerak bo'lgandan ko'proq ovqat iste'mol qila olmayman va bu erda Köpingda topganim ovqatlanishim uchun etarli".
Ko'pgina xlor birikmalari, albatta, Scheeledan ancha oldin ma'lum bo'lgan. Ushbu element ko'plab tuzlarning bir qismidir, shu jumladan eng mashhur - osh tuzi. 1774 yilda Scheele qora mineral piroluzitni konsentrlangan xlorid kislota bilan qizdirish orqali xlorni erkin shaklda ajratib oldi: MnO 2 + 4HCl ® Cl 2 + MnCl 2 + 2H 2 O.
Dastlab, kimyogarlar xlorni element sifatida emas, balki noma'lum element muriya (lotincha muria - sho'r) kislorod bilan kimyoviy birikmasi sifatida ko'rib chiqdilar. Xlorid kislotasi (u murik kislotasi deb ataladi) kimyoviy bog'langan kislorodni o'z ichiga oladi, deb ishonilgan. Bu, xususan, quyidagi fakt bilan "guvohlik qildi": xlor eritmasi yorug'likda turganda, undan kislorod ajralib chiqdi va eritmada xlorid kislota qoldi. Biroq, xlordan kislorodni "yirtib tashlash" bo'yicha ko'plab urinishlar hech qanday natija bermadi. Shunday qilib, xlorni ko'mir bilan isitish orqali hech kim karbonat angidridni ololmadi (yuqori haroratda kislorodni o'z ichiga olgan ko'plab birikmalardan "olib tashlaydi"). Xamfri Deyvi, Jozef Lui Gey-Lyussak va Lui Jak Tenard tomonidan o‘tkazilgan shu kabi tajribalar natijasida xlor tarkibida kislorod yo‘qligi va oddiy modda ekanligi ma’lum bo‘ldi. Xlorning vodorod bilan reaksiyasida gazlarning miqdoriy nisbatini tahlil qilgan Gey-Lyussakning tajribalari xuddi shunday xulosaga keldi.
1811 yilda Davy yangi element uchun "xlor" nomini taklif qildi - yunoncha. "xloros" - sariq-yashil. Bu aynan xlorning rangi. Xuddi shu ildiz "xlorofil" so'zida (yunoncha "xloros" va "fillon" - bargdan). Bir yil o'tgach, Gey-Lyussak bu nomni "xlor" deb "qisqartirdi". Ammo baribir inglizlar (va amerikaliklar) bu elementni "xlor" deb atashadi, frantsuzlar esa uni xlor deb atashadi. Deyarli butun 19-asr davomida kimyoning "qonun chiqaruvchisi" bo'lgan nemislar ham qisqartirilgan nomni qabul qildilar. (nemis tilida xlor - Xlor). 1811 yilda nemis fizigi Iogann Shvayger xlor uchun "galogen" nomini taklif qildi (yunoncha "hals" - tuz va "gennao" - tug'ilishdan). Keyinchalik bu atama nafaqat xlorga, balki uning ettinchi guruhdagi barcha analoglariga - ftor, brom, yod, astatinga ham tegishli edi.
Xlorli atmosferada vodorodning yonishini namoyish qilish qiziq: ba'zida tajriba paytida g'ayrioddiy yon ta'sir paydo bo'ladi: shovqinli ovoz eshitiladi. Ko'pincha, vodorod bilan ta'minlangan yupqa trubka xlor bilan to'ldirilgan konus shaklidagi idishga tushirilganda olov g'ichirlaydi; sferik kolbalar uchun ham xuddi shunday, lekin silindrlarda olov odatda g'ichirlamaydi. Bu hodisa "qo'shiq alangasi" deb nomlangan.
Suvli eritmada xlor suv bilan qisman va ancha sekin reaksiyaga kirishadi; 25 ° C da, muvozanat: Cl 2 + H 2 O HClO + HCl ikki kun ichida o'rnatiladi. Hipoklorik kislota yorug'likda parchalanadi: HClO ® HCl + O. Oqartiruvchi ta'sirga ega bo'lgan atom kislorodidir (mutlaqo quruq xlor bu qobiliyatga ega emas).
Uning birikmalarida xlor barcha oksidlanish darajalarini ko'rsatishi mumkin -1 dan +7 gacha. Kislorod bilan xlor bir qator oksidlarni hosil qiladi, ularning barchasi sof holda beqaror va portlovchidir: Cl 2 O - sariq-to'q sariq gaz, ClO 2 - sariq gaz (9,7 o C dan past - yorqin qizil suyuqlik), xlor perxlorat Cl. 2 O 4 (ClO –ClO 3, ochiq sariq suyuqlik), Cl 2 O 6 (O 2 Cl–O–ClO 3, yorqin qizil suyuqlik), Cl 2 O 7 - rangsiz, juda portlovchi suyuqlik. Past haroratlarda beqaror oksidlar Cl 2 O 3 va ClO 3 olindi. ClO 2 oksidi sanoat miqyosida ishlab chiqariladi va xlor o'rniga pulpani oqartirish va ichimlik suvi va oqava suvlarni zararsizlantirish uchun ishlatiladi. Boshqa halogenlar bilan xlor bir qator intergalogen birikmalar hosil qiladi, masalan, ClF, ClF 3, ClF 5, BrCl, ICl, ICl 3.
Xlor va uning musbat oksidlanish darajasiga ega birikmalari kuchli oksidlovchi moddalardir. 1822 yilda nemis kimyogari Leopold Gmelin xlor bilan oksidlanish yo'li bilan sariq qon tuzidan qizil tuz oldi: 2K 4 + Cl 2 ® K 3 + 2KCl. Xlor bromidlar va xloridlarni oson oksidlaydi, brom va yodni erkin shaklda chiqaradi.
Xlor turli oksidlanish holatlarida bir qator kislotalar hosil qiladi: HCl - xlorid (xlorid, tuzlar - xloridlar), HClO - gipoxlorli (tuzlar - gipoxloritlar), HClO 2 - xlorli (tuzlar - xloritlar), HClO 3 - gipoxlorli (tuzlar - tuzlar) , HClO 4 - xlor (tuzlar - perkloratlar). Kislorodli kislotalardan faqat perklorik kislota sof holatda barqarordir. Kislorod kislotalari tuzlaridan gipoxloritlar amaliy foydalanishda, natriy xlorit NaClO 2 - matolarni oqartirish uchun, kislorodning ixcham pirotexnik manbalarini ("kislorodli shamlar"), kaliy xloratlar (Bertolometa tuzi), kaltsiy va magniy (kaltsiy va magniy) ishlab chiqarish uchun ishlatiladi. gugurt ishlab chiqarishda pirotexnika va portlovchi moddalarning tarkibiy qismlari kabi qishloq xo'jaligi zararkunandalariga qarshi kurashish uchun), perxloratlar - portlovchi moddalar va pirotexnika kompozitsiyalarining tarkibiy qismlari; Ammoniy perklorat qattiq raketa yoqilg'ilarining tarkibiy qismidir.
Xlor ko'plab organik birikmalar bilan reaksiyaga kirishadi. U ikki va uch karrali uglerod-uglerod bog'lari bilan to'yinmagan birikmalarga (atsetilen bilan reaktsiya portlash bilan boradi), yorug'likda esa benzolga tez yopishadi. Muayyan sharoitlarda xlor organik birikmalardagi vodorod atomlarini almashtirishi mumkin: R–H + Cl 2 ® RCl + HCl. Bu reaktsiya organik kimyo tarixida muhim rol o'ynadi. 1840-yillarda frantsuz kimyogari Jan Baptiste Dyuma xlor sirka kislotasi bilan reaksiyaga kirishganda, reaksiya hayratlanarli darajada oson kechishini aniqladi.
CH 3 COOH + Cl 2 ® CH 2 ClCOOH + HCl. Ortiqcha xlor bilan trikloroatsetik kislota CCl 3 COOH hosil bo'ladi. Biroq, ko'plab kimyogarlar Dyumaning ishiga ishonchsiz edilar. Darhaqiqat, Berzeliusning o'sha paytdagi umume'tirof etilgan nazariyasiga ko'ra, musbat zaryadlangan vodorod atomlarini manfiy zaryadlangan xlor atomlari bilan almashtirib bo'lmaydi. O'sha paytda ko'plab taniqli kimyogarlar bu fikrga ega edilar, ular orasida Fridrix Voler, Yustus Liebig va, albatta, Berzeliusning o'zi ham bor edi.
Dyumani masxara qilish uchun Wöhler o'zining do'sti Libigga ma'lum bir S. Windler (Schwindler - nemischa - firibgar) nomidan Dyuma tomonidan kashf qilingan reaktsiyaning yangi muvaffaqiyatli qo'llanilishi haqidagi maqolani topshirdi. Maqolada Wöhler marganets asetat Mn(CH 3 COO) 2 tarkibida barcha elementlarni valentligiga ko'ra xlor bilan almashtirish mumkinligi, natijada faqat xlordan iborat sariq kristall modda paydo bo'lishi haqida ochiq-oydin masxara bilan yozgan. Keyinchalik Angliyada organik birikmalardagi barcha atomlarni ketma-ket xlor atomlari bilan almashtirish orqali oddiy matolar xlorga aylanadi va shu bilan birga narsalar o'z ko'rinishini saqlab qoladi, deyilgan. Izohda aytilishicha, London do'konlarida faqat xlordan iborat bo'lgan materiallar tez sotilmoqda, chunki bu material tungi do'ppilar va issiq ichki ishtonlar uchun juda mos edi.
Xlorning organik birikmalar bilan reaksiyasi koʻplab xlororganik mahsulotlar hosil boʻlishiga olib keladi, ular orasida keng qoʻllaniladigan erituvchilar metilenxlorid CH 2 Cl 2, xloroform CHCl 3, uglerod tetraklorid CCl 4, trikloretilen CHCl=CCl 2, tetraxloretilen Cl2. . Namlik mavjud bo'lganda, xlor o'simliklarning yashil barglarini va ko'plab bo'yoqlarni rangsizlantiradi. Bu 18-asrda ishlatilgan. matolarni oqartirish uchun.
Xlor zaharli gaz sifatida.
Xlorni qabul qilgan Scheele juda yoqimsiz kuchli hidni, nafas olish va yo'talishda qiyinchiliklarni qayd etdi. Keyinchalik ma'lum bo'lishicha, odam bir litr havoda atigi 0,005 mg bu gazni o'z ichiga olgan taqdirda ham xlor hidini sezadi va shu bilan birga u nafas yo'llariga tirnash xususiyati beruvchi ta'sir ko'rsatadi, nafas olish shilliq qavatining hujayralarini yo'q qiladi. trakt va o'pka. 0,012 mg/l konsentratsiyaga chidash qiyin; xlor kontsentratsiyasi 0,1 mg/l dan oshsa, u hayot uchun xavfli bo'ladi: nafas tezlashadi, konvulsiv bo'ladi va keyin tobora kam uchraydi va 5-25 daqiqadan so'ng nafas olish to'xtaydi. Sanoat korxonalari havosidagi maksimal ruxsat etilgan kontsentratsiya 0,001 mg/l, aholi turar joylari havosida esa 0,00003 mg/l ni tashkil qiladi.
Sankt-Peterburglik akademik Toviy Egorovich Lovitz 1790 yilda Scheele tajribasini takrorlab, tasodifan havoga sezilarli miqdordagi xlorni chiqarib yubordi. Uni nafas olgach, u hushini yo'qotdi va yiqildi, keyin sakkiz kun davomida ko'krak qafasidagi chidab bo'lmas og'riqni boshdan kechirdi. Yaxshiyamki, u tuzalib ketdi. Mashhur ingliz kimyogari Deyvi xlordan zaharlanishdan deyarli vafot etdi. Hatto kichik miqdordagi xlor bilan tajribalar ham xavflidir, chunki ular o'pkaga jiddiy zarar etkazishi mumkin. Ularning aytishicha, nemis kimyogari Egon Viberg xlor haqidagi ma'ruzalaridan birini shunday so'zlar bilan boshlagan: "Xlor zaharli gazdir. Agar keyingi namoyishda zaharlansam, iltimos, meni toza havoga olib chiqing. Lekin, afsuski, ma’ruzani to‘xtatishga to‘g‘ri keladi”. Agar siz havoga ko'p miqdorda xlor chiqarsangiz, bu haqiqiy falokatga aylanadi. Buni Birinchi Jahon urushi paytida ingliz-fransuz qo'shinlari boshdan kechirdilar. 1915 yil 22 aprel kuni ertalab nemis qo'mondonligi urushlar tarixidagi birinchi gaz hujumini amalga oshirishga qaror qildi: shamol dushman tomon esganda, Belgiyaning Ypres shahri yaqinidagi frontning olti kilometrlik kichik qismida. , har birida 30 kg suyuq xlor bo'lgan 5730 ballonning klapanlari bir vaqtning o'zida ochildi. 5 daqiqa ichida ulkan sariq-yashil bulut paydo bo'ldi, u asta-sekin nemis xandaqlaridan ittifoqchilar tomon uzoqlashdi. Ingliz va frantsuz askarlari butunlay himoyasiz edilar. Gaz barcha boshpanalarga yoriqlar orqali kirib bordi: undan qutulishning iloji yo'q edi: axir, gaz niqobi hali ixtiro qilinmagan edi. Natijada 15 ming kishi zaharlandi, ulardan 5 ming nafari halok bo'ldi. Bir oy o'tgach, 31-may kuni nemislar sharqiy frontda - rus qo'shinlariga qarshi gaz hujumini takrorladilar. Bu Polshada Bolimova shahri yaqinida sodir bo'ldi. 12 km frontda 12 ming ballondan 264 tonna xlor aralashmasi va undan ko'p zaharli fosgen (karbon kislotasi xlorid COCl 2) ajralib chiqdi. Chor qo'mondonligi Ipreda sodir bo'lgan voqealarni bilar edi, ammo rus askarlarida mudofaa vositalari yo'q edi! Gaz hujumi natijasida yo'qotishlar 9146 kishini tashkil etdi, ulardan atigi 108 nafari miltiq va artilleriya o'qlari natijasida, qolganlari zaharlangan. Shu bilan birga, 1183 kishi deyarli darhol vafot etdi.
Ko'p o'tmay, kimyogarlar xlordan qanday qutulish kerakligini ko'rsatdilar: siz natriy tiosulfat eritmasiga namlangan doka bandaji orqali nafas olishingiz kerak (bu modda fotografiyada qo'llaniladi, u ko'pincha giposulfit deb ataladi). Xlor tiosulfat eritmasi bilan juda tez reaksiyaga kirishib, uni oksidlaydi:
Na 2 S 2 O 3 + 4Cl 2 + 5H 2 O ® 2H 2 SO 4 + 2NaCl + 6HCl. Albatta, sulfat kislota ham zararsiz modda emas, lekin uning suyultirilgan suvli eritmasi zaharli xlorga qaraganda kamroq xavflidir. Shuning uchun, o'sha yillarda tiosulfat boshqa nomga ega edi - "antixlor", ammo birinchi tiosulfat gaz maskalari unchalik samarali emas edi.
1916 yilda rus kimyogari va bo'lajak akademik Nikolay Dmitrievich Zelinskiy zaharli moddalar faollashtirilgan uglerod qatlami tomonidan ushlab turiladigan haqiqiy samarali gaz niqobini ixtiro qildi. Juda rivojlangan sirtga ega bo'lgan bunday ko'mir giposulfitga namlangan dokadan ko'ra ko'proq xlorni saqlab qolishi mumkin edi. Yaxshiyamki, "xlor hujumlari" tarixda faqat fojiali epizod bo'lib qoldi. Jahon urushidan keyin xlor faqat tinch kasblarga ega edi.
Xlordan foydalanish.
Har yili dunyo bo'ylab katta miqdorda xlor ishlab chiqariladi - o'nlab million tonna. Faqat AQShda 20-asrning oxiriga kelib. Har yili elektroliz yo'li bilan 12 million tonna xlor ishlab chiqarilgan (kimyoviy ishlab chiqarish orasida 10-o'rin). Uning asosiy qismi (50% gacha) organik birikmalarni xlorlash - erituvchilar, sintetik kauchuk, polivinilxlorid va boshqa plastmassalar, xloropren kauchuk, pestitsidlar, dori-darmonlar va boshqa ko'plab zarur va foydali mahsulotlarni ishlab chiqarishga sarflanadi. Qolgan qismi noorganik xloridlarni sintez qilish uchun, sellyuloza va qog'oz sanoatida yog'och pulpasini oqartirish va suvni tozalash uchun sarflanadi. Xlor metallurgiya sanoatida nisbatan kam miqdorda ishlatiladi. Uning yordami bilan juda sof metallar - titanium, qalay, tantal, niobiy olinadi. Vodorodni xlorda yoqish orqali vodorod xlorid, undan xlorid kislotasi olinadi. Xlor, shuningdek, oqartiruvchi moddalar (gipoxloritlar, oqartiruvchi) ishlab chiqarish va suvni xlorlash orqali zararsizlantirish uchun ishlatiladi.
Ilya Leenson
| Xlor | |
|---|---|
| Atom raqami | 17 |
| Oddiy moddaning ko'rinishi | Gaz o'tkir hidli sariq-yashil rangga ega. Zaharli. |
| Atomning xossalari | |
| Atom massasi (molyar massa) |
35,4527 amu (g/mol) |
| Atom radiusi | 22:00 |
| Ionizatsiya energiyasi (birinchi elektron) |
1254.9(13.01) kJ/mol (eV) |
| Elektron konfiguratsiya | 3s 2 3p 5 |
| Kimyoviy xossalari | |
| Kovalent radius | 99:00 |
| Ion radiusi | (+7e)27 (-1e)181 pm |
| Elektromanfiylik (Paulingga ko'ra) |
3.16 |
| Elektrod potentsiali | 0 |
| Oksidlanish holatlari | 7, 6, 5, 4, 3, 1, −1 |
| Oddiy moddaning termodinamik xossalari | |
| Zichlik | (-33,6 °C da)1,56 g/sm³ |
| Molar issiqlik sig'imi | 21,838 J/(K mol) |
| Issiqlik o'tkazuvchanligi | 0,009 Vt/(·K) |
| Erish harorati | 172.2 |
| Erish issiqligi | 6,41 kJ/mol |
| Qaynatish harorati | 238.6 |
| Bug'lanish issiqligi | 20,41 kJ/mol |
| Molyar hajm | 18,7 sm³/mol |
| Oddiy moddaning kristall panjarasi | |
| Panjara tuzilishi | ortorombik |
| Panjara parametrlari | a=6,29 b=4,50 c=8,21 Å |
| c/a nisbati | — |
| Debay harorati | yo'q K |
Xlor (χλωρός - yashil) - ettinchi guruhning asosiy kichik guruhining elementi, kimyoviy elementlar davriy jadvalining uchinchi davri, atom raqami 17.
XLOR elementi belgi bilan ifodalanadi Cl(lat. Xlor). Kimyoviy faol metall bo'lmagan. U galogenlar guruhiga kiradi (dastlab "galogen" nomini nemis kimyogari Shvayger xlor uchun ishlatgan [so'zma-so'z "galogen" tuz deb tarjima qilingan), ammo u ushlanmadi va keyinchalik VII guruh uchun odatiy holga aylandi. xlorni o'z ichiga olgan elementlar).
Oddiy modda xlor(CAS raqami: 7782-50-5) normal sharoitda sarg'ish-yashil rangli, o'tkir hidli zaharli gazdir. Xlor molekulasi ikki atomli (formula Cl 2).
Xlorning kashf etilishi tarixi
Xlor atomining diagrammasi
Xlor birinchi marta 1772 yilda Scheele tomonidan olingan bo'lib, u piroluzitning xlorid kislotasi bilan o'zaro ta'siri paytida uning chiqarilishini piroluzit haqidagi risolasida tasvirlab bergan:
4HCl + MnO2 = Cl2 + MnCl2 + 2H2O
Scheele, akva regia hidiga o'xshash xlorning hidini, uning oltin va kinobar bilan reaksiyaga kirishish qobiliyatini va uning oqartiruvchi xususiyatlarini qayd etdi.
Scheele, o'sha paytda kimyoda hukmron bo'lgan flogiston nazariyasiga ko'ra, xlorning deflogistika ekanligini aytdi. xlorid kislotasi, ya'ni xlorid kislota oksidi. Bertolet va Lavuazye xlor elementning oksidi ekanligini ta'kidladilar Muriya, ammo uni ajratib olishga urinishlar, stol tuzini elektroliz orqali parchalashga muvaffaq bo'lgan Davyning ishigacha muvaffaqiyatsiz bo'ldi. natriy Va xlor.
Tabiatda tarqalishi
Tabiatda xlorning ikkita izotopi mavjud: 35 Cl va 37 Cl. Yer qobig'ida xlor eng keng tarqalgan halogendir. Xlor juda faol - davriy jadvalning deyarli barcha elementlari bilan bevosita birlashadi.
Tabiatda u faqat minerallarda birikmalar holida uchraydi: galit NaCI, silvit KCl, silvinit KCl NaCl, bisxofit MgCl 2 6H2O, karnallit KCl MgCl 2 6H 2 O, kainit KCl MgSO 4 3H 2 Eng katta. xlor zahiralari dengiz va okeanlar suvlari tuzlarida mavjud.
Xlor er qobig'idagi umumiy atomlar sonining 0,025% ni tashkil qiladi, xlorning klark soni 0,19% ni tashkil qiladi, inson tanasida esa massa bo'yicha 0,25% xlor ionlari mavjud. Inson va hayvonlar organizmida xlor asosan hujayralararo suyuqliklarda (shu jumladan qonda) bo'ladi va osmotik jarayonlarni tartibga solishda, shuningdek, asab hujayralarining ishlashi bilan bog'liq jarayonlarda muhim rol o'ynaydi.
Izotopik tarkibi
Tabiatda xlorning 2 ta barqaror izotopi mavjud: massa soni 35 va 37. Ularning tarkibidagi nisbati mos ravishda 75,78% va 24,22%.
| Izotop | Nisbiy massa, a.m.u. | Yarim hayot | Buzilish turi | Yadro spini |
|---|---|---|---|---|
| 35 Cl | 34.968852721 | Barqaror | — | 3/2 |
| 36 Cl | 35.9683069 | 301000 yil | 36 Ar da b-emirilish | 0 |
| 37 Cl | 36.96590262 | Barqaror | — | 3/2 |
| 38Cl | 37.9680106 | 37,2 daqiqa | 38 Ar da b parchalanishi | 2 |
| 39 Cl | 38.968009 | 55,6 daqiqa | b yemirilishi 39 Ar gacha | 3/2 |
| 40 Cl | 39.97042 | 1,38 daqiqa | 40 Ar da b parchalanishi | 2 |
| 41Cl | 40.9707 | 34 s | b yemirilishi 41 Ar | |
| 42 Cl | 41.9732 | 46,8 s | b yemirilishi 42 Ar | |
| 43 Cl | 42.9742 | 3,3 s | 43 Ar da b-emirilish |
Fizikaviy va fizik-kimyoviy xossalari
Oddiy sharoitlarda xlor bo'g'uvchi hidli sariq-yashil gazdir. Uning ba'zi jismoniy xususiyatlari jadvalda keltirilgan.
| Mulk | Ma'nosi |
|---|---|
| Qaynatish harorati | -34 °C |
| Erish harorati | -101 °C |
| Parchalanish harorati (atomlarga ajralish) |
~1400°C |
| Zichlik (gaz, n.s.) | 3,214 g/l |
| Atomning elektronga yaqinligi | 3,65 eV |
| Birinchi ionlanish energiyasi | 12,97 eV |
| Issiqlik quvvati (298 K, gaz) | 34,94 (J/mol K) |
| Kritik harorat | 144 °C |
| Kritik bosim | 76 atm |
| Standart shakllanish entalpiyasi (298 K, gaz) | 0 (kJ/mol) |
| Standart shakllanish entropiyasi (298 K, gaz) | 222,9 (J/mol K) |
| Erish entalpiyasi | 6,406 (kJ/mol) |
| Qaynatish entalpiyasi | 20,41 (kJ/mol) |
Sovutilganda xlor taxminan 239 K haroratda suyuqlikka aylanadi, so'ngra 113 K dan past bo'shliq guruhiga ega bo'lgan ortorombik panjaraga kristallanadi. Cmca va parametrlar a=6,29 b=4,50, c=8,21. 100 K dan pastda kristall xlorning ortorombik modifikatsiyasi tetragonal bo'lib, kosmik guruhga ega bo'ladi. P4 2/ncm va panjara parametrlari a=8,56 va c=6,12.
Eruvchanlik
Xlor molekulasining dissotsilanish darajasi Cl 2 → 2Cl. 1000 K da 2,07*10 -4%, 2500 K da 0,909% ni tashkil qiladi.
Havodagi hidni sezish chegarasi 0,003 (mg/l) ni tashkil qiladi.
CAS reestrida - 7782-50-5 raqami.
Elektr o'tkazuvchanligi bo'yicha suyuq xlor eng kuchli izolyatorlar qatoriga kiradi: u oqimni distillangan suvdan deyarli milliard marta va kumushdan 10 22 marta yomonroq o'tkazadi. Xlordagi tovush tezligi havoga qaraganda taxminan bir yarim baravar kam.
Kimyoviy xossalari
Elektron qobiqning tuzilishi
Xlor atomining valentlik darajasi 1 ta juftlashtirilmagan elektronni o'z ichiga oladi: 1S² 2S² 2p 6 3S² 3p 5, shuning uchun xlor atomi uchun 1 valentlik juda barqaror. Xlor atomida band bo'lmagan d-pastki darajali orbital mavjudligi sababli, xlor atomi boshqa valentliklarni namoyon qilishi mumkin. Atomning qo'zg'aluvchan holatlarini shakllantirish sxemasi:
Xlor birikmalari ham ma'lumki, ularda xlor atomi rasmiy ravishda 4 va 6 valentlikni namoyon qiladi, masalan, ClO 2 va Cl 2 O 6. Biroq, bu birikmalar radikaldir, ya'ni ular bitta juftlashtirilmagan elektronga ega.
Metallar bilan o'zaro ta'siri
Xlor deyarli barcha metallar bilan bevosita reaksiyaga kirishadi (ba'zilari faqat namlik borligida yoki qizdirilganda):
Cl 2 + 2Na → 2NaCl 3Cl 2 + 2Sb → 2SbCl 3 3Cl 2 + 2Fe → 2FeCl 3
Metall bo'lmaganlar bilan o'zaro ta'sir
Yorug'likda yoki qizdirilganda radikal mexanizm bo'yicha vodorod bilan faol (ba'zan portlash bilan) reaksiyaga kirishadi. Xlorning vodorod bilan aralashmalari, tarkibida 5,8% dan 88,3% gacha vodorod bo'lib, nurlanish paytida vodorod xloridini hosil qilish uchun portlaydi. Kichik konsentratsiyalarda xlor va vodorod aralashmasi rangsiz yoki sariq-yashil olov bilan yonadi. Vodorod-xlor alangasining maksimal harorati 2200 °C:
Cl 2 + H 2 → 2HCl 5Cl 2 + 2P → 2PCl 5 2S + Cl 2 → S 2 Cl 2 Cl 2 + 3F 2 (masalan,) → 2ClF 3
Boshqa xususiyatlar
Cl 2 + CO → COCl 2Suvda yoki ishqorlarda eritilganda xlor dismutatsiyaga uchrab, gipoxlorli (va qizdirilganda perklorik) va xlorid kislotalarni yoki ularning tuzlarini hosil qiladi:
Cl 2 + H 2 O → HCl + HClO 3Cl 2 + 6NaOH → 5NaCl + NaClO 3 + 3H 2 O Cl 2 + Ca(OH) 2 → CaCl(OCl) + H 2 O 4NH 3 + 3Cl 2 → NCl + 3NH 3 4 Cl
Xlorning oksidlovchi xossalari
Cl 2 + H 2 S → 2HCl + SOrganik moddalar bilan reaksiyalar
CH 3 -CH 3 + Cl 2 → C 2 H 6-x Cl x + HClKo'p bog'lar orqali to'yinmagan birikmalarga birikadi:
CH 2 =CH 2 + Cl 2 → Cl-CH 2 -CH 2 -Cl
Aromatik birikmalar katalizatorlar ishtirokida vodorod atomini xlor bilan almashtiradi (masalan, AlCl 3 yoki FeCl 3):
C 6 H 6 + Cl 2 → C 6 H 5 Cl + HCl
Qabul qilish usullari
Sanoat usullari
Dastlab, xlor ishlab chiqarishning sanoat usuli Scheele usuliga, ya'ni piroluzitning xlorid kislotasi bilan reaktsiyasiga asoslangan edi:
MnO 2 + 4HCl → MnCl 2 + Cl 2 + 2H 2 O
1867 yilda Dikon vodorod xloridni atmosfera kislorodi bilan katalitik oksidlash orqali xlor ishlab chiqarish usulini ishlab chiqdi. Hozirgi vaqtda Deacon jarayoni organik birikmalarning sanoat xlorlanishining yon mahsuloti bo'lgan vodorod xloriddan xlorni olish uchun ishlatiladi.
4HCl + O 2 → 2H 2 O + 2Cl 2
Bugungi kunda xlor sanoat miqyosida natriy gidroksid va vodorod bilan birga osh tuzi eritmasini elektroliz qilish orqali ishlab chiqariladi:
2NaCl + 2H 2 O → H 2 + Cl 2 + 2NaOH Anod: 2Cl - - 2e - → Cl 2 0 Katod: 2H 2 O + 2e - → H 2 + 2OH -
Suvning elektrolizi natriy xloridning elektroliziga parallel ravishda sodir bo'lganligi sababli, umumiy tenglamani quyidagicha ifodalash mumkin:
1,80 NaCl + 0,50 H 2 O → 1,00 Cl 2 + 1,10 NaOH + 0,03 H 2
Xlor ishlab chiqarish uchun elektrokimyoviy usulning uchta varianti qo'llaniladi. Ulardan ikkitasi qattiq katod bilan elektroliz: diafragma va membrana usullari, uchinchisi suyuq simob katodi bilan elektroliz (simob ishlab chiqarish usuli). Elektrokimyoviy ishlab chiqarish usullari orasida eng oson va qulay usul simob katodi bilan elektrolizdir, ammo bu usul metall simobning bug'lanishi va oqishi natijasida atrof-muhitga sezilarli zarar etkazadi.
Qattiq katodli diafragma usuli
Elektrolizator bo'shlig'i g'ovakli asbest bo'linmasi - diafragma orqali elektrolizatorning katodi va anodlari joylashgan katod va anod bo'shliqlariga bo'linadi. Shuning uchun bunday elektrolizator ko'pincha diafragma deb ataladi va ishlab chiqarish usuli diafragma elektrolizidir. Diafragma elektrolizatorining anod bo'shlig'iga to'yingan anolit (NaCl eritmasi) oqimi doimiy ravishda oqadi. Elektrokimyoviy jarayon natijasida galitning parchalanishi natijasida anodda xlor, suvning parchalanishi natijasida katodda vodorod ajralib chiqadi. Bunda katodga yaqin zona natriy gidroksid bilan boyitiladi.
Qattiq katodli membrana usuli
Membran usuli asosan diafragma usuliga o'xshaydi, ammo anod va katod bo'shliqlari kation almashinadigan polimer membranasi bilan ajratilgan. Membranani ishlab chiqarish usuli diafragma usulidan ko'ra samaraliroq, ammo ulardan foydalanish qiyinroq.
Suyuq katod bilan simob usuli
Jarayon elektrolitik vannada amalga oshiriladi, u elektrolizator, parchalovchi va simob nasosidan iborat bo'lib, kommunikatsiyalar bilan o'zaro bog'langan. Elektrolitik vannada simob simob nasosi ta'sirida elektrolizator va parchalovchidan o'tib aylanadi. Elektrolizatorning katodi simob oqimidir. Anodlar - grafit yoki kam eskirish. Simob bilan birgalikda elektrolizator orqali anolit oqimi, natriy xlorid eritmasi doimiy ravishda oqadi. Xloridning elektrokimyoviy parchalanishi natijasida anodda xlor molekulalari, katodda esa ajralib chiqqan natriy simobda eriydi va amalgama hosil qiladi.
Laboratoriya usullari
Laboratoriyalarda xlor odatda vodorod xloridni kuchli oksidlovchi moddalar (masalan, marganets (IV) oksidi, kaliy permanganat, kaliy bixromat) bilan oksidlanishiga asoslangan jarayonlar yordamida ishlab chiqariladi:
2KMnO 4 + 16HCl → 2KCl + 2MnCl 2 + 5Cl 2 +8H 2 O K 2 Cr 2 O 7 + 14HCl → 3Cl 2 + 2KCl + 2CrCl 3 + 7H 2 O
Xlorni saqlash
Ishlab chiqarilgan xlor maxsus "tanklar" larda saqlanadi yoki yuqori bosimli po'lat tsilindrlarga pompalanadi. Bosim ostida suyuq xlorli tsilindrlar maxsus rangga ega - botqoq rangi. Shuni ta'kidlash kerakki, xlor tsilindrlaridan uzoq muddat foydalanish paytida ularda o'ta portlovchi azot trixlorid to'planadi va shuning uchun vaqti-vaqti bilan xlor ballonlari muntazam yuvish va azot xloridni tozalashdan o'tishi kerak.
Xlor sifati standartlari
GOST 6718-93 ga muvofiq “Suyuq xlor. Texnik spetsifikatsiyalar "xlorning quyidagi navlari ishlab chiqariladi
Ilova
Xlor ko'plab sanoat, fan va maishiy ehtiyojlarda qo'llaniladi:

Oqartirgichlarning asosiy komponenti xlorli suvdir.
- Polivinilxlorid, plastmassa aralashmalari, sintetik kauchuk ishlab chiqarishda: sim izolyatsiyasi, deraza profillari, qadoqlash materiallari, kiyim-kechak va poyabzal, linoleum va yozuvlar, laklar, asbob-uskunalar va ko'pikli plastmassalar, o'yinchoqlar, asboblar qismlari, qurilish materiallari. Polivinilxlorid vinilxloridning polimerizatsiyasi natijasida ishlab chiqariladi, bugungi kunda u ko'pincha etilendan xlor-muvozanatli usulda oraliq 1,2-dikloroetan orqali ishlab chiqariladi.
- Xlorning oqartiruvchi xususiyatlari uzoq vaqtdan beri ma'lum, garchi xlorning o'zi "oqartuvchi" emas, balki gipoxlorid kislotaning parchalanishi paytida hosil bo'lgan atom kislorodi: Cl 2 + H 2 O → HCl + HClO → 2HCl + O.. Mato, qog'oz, kartonni oqartirishning bu usuli bir necha asrlardan beri qo'llanilgan.
- Organoklorli insektitsidlarni ishlab chiqarish - ekinlar uchun zararli hasharotlarni o'ldiradigan, ammo o'simliklar uchun xavfsiz moddalar. Ishlab chiqarilgan xlorning katta qismi o'simliklarni himoya qilish vositalarini olish uchun sarflanadi. Eng muhim insektitsidlardan biri geksaxlorotsikloheksan (ko'pincha geksaxloran deb ataladi). Ushbu modda birinchi marta 1825 yilda Faraday tomonidan sintez qilingan, ammo u 100 yildan ko'proq vaqt o'tgach - asrimizning 30-yillarida amaliy qo'llanilishini topdi.
- U kimyoviy jangovar vosita sifatida, shuningdek, boshqa kimyoviy jangovar vositalarni ishlab chiqarish uchun ishlatilgan: musluk suvi, ammo ular xlor birikmalarining zararsizlantiruvchi ta'siriga alternativa taklif qila olmaydi. Suv quvurlari ishlab chiqarilgan materiallar xlorli musluk suvi bilan turlicha o'zaro ta'sir qiladi. Musluk suvidagi erkin xlor poliolefin asosidagi quvurlarning xizmat muddatini sezilarli darajada qisqartiradi: har xil turdagi polietilen quvurlar, shu jumladan o'zaro bog'langan polietilen, PEX (PE-X) deb nomlanuvchi yirik. AQShda polimer materiallardan tayyorlangan quvurlarni xlorli suv bilan suv ta'minoti tizimlarida foydalanishga ruxsat berishni nazorat qilish uchun ular 3 ta standartni qabul qilishga majbur bo'ldilar: o'zaro bog'langan polietilen (PEX) quvurlari va issiq xlorli suvga nisbatan ASTM F2023; Barcha polietilen quvurlar va xlorli suvga nisbatan ASTM F2263 va ASTM F2330 ko'p qatlamli (metall-polimer) quvurlar va issiq xlorli suv uchun qo'llaniladi. Xlorli suv bilan o'zaro ta'sirlashganda chidamlilik nuqtai nazaridan ijobiy reaktsiya misning yonishi bilan namoyon bo'ladi (ichaklar. Xlorning so'rilishi va chiqarilishi natriy ionlari va bikarbonatlar bilan chambarchas bog'liq, mineralokortikoidlar va Na + /K + faolligi bilan kamroq darajada -. ATPaz - barcha xlorning 10-15%, shundan 1/3 dan 1/2 gacha xlor hujayradan tashqarida bo'ladi (90-95%) %) va najas (4-8%) va teri orqali (2% gacha) Xlorning chiqarilishi natriy va kaliy ionlari bilan va o'zaro HCO 3 - (kislota-baz muvozanati) bilan bog'liq.
Bir kishi kuniga 5-10 g NaCl iste'mol qiladi. Insonning xlorga bo'lgan minimal ehtiyoji kuniga taxminan 800 mg ni tashkil qiladi. Bola kerakli miqdorda xlorni ona suti orqali oladi, uning tarkibida 11 mmol/l xlor mavjud. NaCl oshqozonda xlorid kislota ishlab chiqarish uchun zarur bo'lib, u hazm qilishni rag'batlantiradi va patogen bakteriyalarni yo'q qiladi. Hozirgi vaqtda odamlarda ba'zi kasalliklarning paydo bo'lishida xlorning ishtiroki yaxshi o'rganilmagan, bu asosan tadqiqotlar sonining kamligi bilan bog'liq. Xlorni kunlik iste'mol qilish bo'yicha tavsiyalar ham ishlab chiqilmaganligini aytish kifoya. Inson mushak to'qimasida 0,20-0,52% xlor, suyak to'qimasida - 0,09%; qonda - 2,89 g/l. O'rtacha odam tanasida (tana vazni 70 kg) 95 g xlor mavjud. Har kuni odam ovqatdan 3-6 g xlor oladi, bu esa ushbu elementga bo'lgan ehtiyojni qoplaydi.
Xlor ionlari o'simliklar uchun juda muhimdir. Xlor o'simliklarda energiya almashinuvida ishtirok etadi, oksidlovchi fosforlanishni faollashtiradi. Izolyatsiya qilingan xloroplastlar tomonidan fotosintez jarayonida kislorod hosil bo'lishi uchun zarurdir va fotosintezning yordamchi jarayonlarini, birinchi navbatda energiya to'planishi bilan bog'liq jarayonlarni rag'batlantiradi. Xlor kislorod, kaliy, kaltsiy va magniy birikmalarining ildizlar tomonidan so'rilishiga ijobiy ta'sir ko'rsatadi. O'simliklardagi xlor ionlarining haddan tashqari konsentratsiyasi ham salbiy tomonga ega bo'lishi mumkin, masalan, xlorofill tarkibini kamaytiradi, fotosintez faolligini pasaytiradi, o'simliklarning o'sishi va rivojlanishini sekinlashtiradi. Ammo shunday o'simliklar borki, ular evolyutsiya jarayonida yoki tuproq sho'rlanishiga moslashgan yoki kosmos uchun kurashda raqobat bo'lmagan bo'sh sho'rlarni egallagan. Sho'rlangan tuproqlarda o'sadigan o'simliklar galofitlar deb ataladi, ular vegetatsiya davrida xloridlarni to'playdi va keyin barglarning tushishi yoki xloridlarni barglar va novdalar yuzasiga chiqaradi va quyosh nurlaridan yuzalarni soya qilib, ikki baravar foyda oladi. Rossiyada galofitlar Basqunchak va Elton shoʻr koʻllari atrofidagi shoʻr gumbazlar, shoʻr qatlamlar va shoʻrlangan chuqurliklarda oʻsadi.
Mikroorganizmlar orasida juda sho'rlangan suvlarda yoki tuproqlarda yashaydigan galofillar - galobakteriyalar ham ma'lum.
Operatsion xususiyatlari va ehtiyot choralari
Xlor zaharli, bo'g'uvchi gaz bo'lib, agar u o'pkaga kirsa, o'pka to'qimalarining kuyishiga va bo'g'ilishga olib keladi. Havoda taxminan 0,006 mg / l konsentratsiyada (ya'ni, xlor hidini idrok etish chegarasidan ikki baravar yuqori) nafas olish yo'llariga tirnash xususiyati beruvchi ta'sir ko'rsatadi. Xlor Birinchi jahon urushida Germaniya tomonidan qo'llanilgan birinchi kimyoviy moddalardan biri edi. Xlor bilan ishlashda siz himoya kiyim, gaz niqobi va qo'lqopdan foydalanishingiz kerak. Qisqa vaqt ichida siz nafas a'zolarini xlorning kirib kelishidan natriy sulfit Na 2 SO 3 yoki natriy tiosulfat Na 2 S 2 O 3 eritmasi bilan namlangan mato bandaji bilan himoya qilishingiz mumkin.
Atmosfera havosida xlorning ruxsat etilgan maksimal kontsentratsiyasi quyidagicha: o'rtacha kunlik - 0,03 mg/m³; maksimal yagona doz - 0,1 mg/m³; sanoat korxonasining ish joylarida - 1 mg/m³.
qo'shimcha ma'lumot
Rossiyada xlor ishlab chiqarish
Oltin xlorid
Xlorli suv
Oqartiruvchi kukun
Birinchi asosli xloridni qayta ishlang
Reize ikkinchi asosli xloridXlorli birikmalar
Gipoxloritlar
Perkloratlar
Kislota xloridlari
Xloratlar
Xloridlar
Organik xlorli birikmalarTahlil qilingan
— Cl- va K+ tarkibini tahlil qiluvchi ESR-10101 mos yozuvlar elektrodlaridan foydalanish.
Jismoniy xususiyatlar. Oddiy sharoitlarda xlor o'tkir hidli sariq-yashil gaz bo'lib, zaharli hisoblanadi. U havodan 2,5 baravar og'irroq. 20 daraja haroratda 1 hajm suvda. C taxminan 2 hajm xlorni eritadi. Bu eritma xlorli suv deb ataladi.
Atmosfera bosimida xlor -34 daraja. C suyuq holatga o'tadi va -101 daraja. C qattiqlashadi. Xona haroratida u faqat 600 kPa (6 atm) bosim ostida suyuqlikka aylanadi. Xlor ko'pgina organik erituvchilarda, ayniqsa uglerod tetrakloridida juda yaxshi eriydi, ular bilan reaksiyaga kirishmaydi.
Kimyoviy xossalari. Xlor atomining tashqi elektron darajasi 7 ta elektronni o'z ichiga oladi (s 2 p 5), shuning uchun u elektronni osongina qo'shib, Cl - anionni hosil qiladi. To'ldirilmagan d-darajasi mavjudligi sababli xlor atomida 1, 3, 5 va 7 juftlashtirilmagan elektronlar paydo bo'lishi mumkin, shuning uchun kislorod o'z ichiga olgan birikmalarda u +1, +3, +5 va + oksidlanish darajasiga ega bo'lishi mumkin. 7.
Namlik bo'lmasa, xlor juda inert, ammo namlik izlari bo'lsa ham, uning faolligi keskin oshadi. U metallar bilan yaxshi ta'sir qiladi:
2 Fe + 3 Cl 2 = 2 FeCl 3 (temir (III) xlorid);
Cu + Cl 2 = CuCl 2 (mis (II) xlorid)
va ko'p metall bo'lmaganlar:
H 2 + Cl 2 = 2 HCl (vodorod xlorid);
2 S + Cl 2 = S 2 Cl 2 (oltingugurt xlorid (1));
Si + 2 Cl 2 = SiCl 4 (kremniy xlorid (IV));
2 P + 5 Cl 2 = 2 PCl 5 (fosfor (V) xlorid).
Xlor to'g'ridan-to'g'ri kislorod, uglerod va azot bilan o'zaro ta'sir qilmaydi.
Xlor suvda eritilganda 2 ta kislota hosil bo'ladi: xlorid yoki xlorid va gipoxlorli:
Cl 2 + H 2 O = HCl + HClO.
Xlor sovuq ishqor eritmalari bilan reaksiyaga kirishganda, bu kislotalarning tegishli tuzlari hosil bo'ladi:
Cl 2 + 2 NaOH = NaCl + NaClO + H 2 O.
Olingan eritmalar Javel suvi deb ataladi, u xlorli suv kabi ClO ioni mavjudligi sababli kuchli oksidlovchi xususiyatlarga ega - mato va qog'ozni oqartirish uchun ishlatiladi. Ishqorlarning issiq eritmalari bilan xlor xlorid va perklorik kislotalarning tegishli tuzlarini hosil qiladi:
3 Cl 2 + 6 NaOH = 5 NaCl + NaClO 3 + 3 H 2 O;
3 Cl 2 + 6 KOH = 5 KCl + KClO 3 + 3 H 2 O.
Olingan kaliy xlorat Bertolet tuzi deb ataladi.
Qizdirilganda xlor ko'plab organik moddalar bilan osongina o'zaro ta'sir qiladi. To'yingan va aromatik uglevodorodlarda u vodorod o'rnini bosadi, xlororganik birikma va vodorod xlorid hosil qiladi va to'yinmagan uglevodorodlarni qo'sh yoki uch bog'lanish joyida birlashtiradi.
Juda yuqori haroratlarda xlor vodorodni ugleroddan butunlay olib tashlaydi. Bu vodorod xlorid va kuyikish hosil qiladi. Shuning uchun uglevodorodlarni yuqori haroratda xlorlash doimo kuyikish bilan birga keladi.
Xlor kuchli oksidlovchi moddadir, shuning uchun u yuqori valentlik darajasiga qadar oksidlanishi mumkin bo'lgan elementlarni o'z ichiga olgan murakkab moddalar bilan osongina o'zaro ta'sir qiladi:
2 FeCl 2 + Cl 2 = 2 FeCl 3;
H 2 SO 3 + Cl 2 + H 2 O = H 2 SO 4 + 2 HCl.