Qanday birikmalar fenollar deyiladi. Fenollarning kimyoviy xossalari. Fenol birikmalarining biologik roli
Fenollar aromatik spirtlarning umumiy nomi. Xususiyatlari bo'yicha moddalar zaif kislotalardir. Sinfning eng oddiy vakili bo'lgan gidroksibenzol C 6 H 5 0H (fenol formulasi) ning ko'plab gomologlari katta amaliy ahamiyatga ega. Keling, buni batafsil ko'rib chiqaylik.
Fenollar. Umumiy formula va tasnifi
Aromatik spirtlarga tegishli organik moddalarning umumiy formulasi R-OH. Fenollar va krezollar molekulalarining o'zlari radikal - fenil C6H5 tomonidan hosil bo'ladi, ular bilan bir yoki bir nechta gidroksil guruhlari OH (gidroksiguruhlar) bevosita bog'lanadi. Molekuladagi soniga ko'ra fenollar mono-, ikki va ko'p atomlilarga bo'linadi. Ushbu turdagi monotomik birikmalar fenol va krezoldir. Ko'p atomli gidroksibenzollar orasida eng keng tarqalgani naftollar bo'lib, ularda 2 ta kondensatsiyalangan yadro mavjud.
Fenol aromatik spirtlarning vakili
Fenol to'qimachilik ishchilariga 18-asrda ma'lum bo'lgan: to'quvchilar uni bo'yoq sifatida ishlatishgan. 1834 yilda ko'mir smolasini distillashda nemis kimyogari F. Runge bu moddaning kristallarini o'ziga xos shirin hid bilan ajratib oldi. Lotin nomi ko'mir - karbon, shuning uchun birikma (karbol kislotasi) deb ataldi. Nemis tadqiqotchisi moddaning tarkibini aniqlay olmadi. Fenolning molekulyar formulasi 1842 yilda O. Loran tomonidan asos solingan, u karbol kislotasini benzolning hosilasi deb hisoblagan. Yangi kislota uchun "fenil" nomi ishlatilgan. Charlz Jerard bu moddaning spirt ekanligini aniqladi va uni fenol deb nomladi. Murakkabni qo'llashning dastlabki sohalari tibbiyot, terini ko'nchilik va sintetik bo'yoqlar ishlab chiqarishdir. Ko'rib chiqilayotgan moddaning xususiyatlari:
- Ratsional kimyoviy formula C 6 H 5 OH.
- ulanishlar - 94,11 a. yemoq.
- Tarkibni aks ettiruvchi yalpi formula C 6 H 6 O dir.

Fenol molekulasining elektron va fazoviy tuzilishi
Benzolning siklik tuzilish formulasini 1865 yilda nemis organik kimyogari F.Kekule, undan biroz oldin esa I.Loshmidt taklif qilgan. Olimlar organik moddaning molekulasini o'zgaruvchan bitta va qo'sh bog'larga ega deb tasavvur qilishdi. tomonidan zamonaviy g'oyalar, aromatik halqa "konjugatsiyalangan bog'lanish" deb ataladigan halqa tuzilishining maxsus turidir.
Oltita uglerod atomi C elektron orbitallarning sp 2 gibridlanish jarayonidan o'tadi. C-C bog'lanishlar hosil bo'lishida ishtirok etmaydigan p-elektron bulutlari molekulyar yadro tekisligidan yuqorida va pastda bir-biriga yopishadi. Umumiy elektron bulutning ikkita qismi paydo bo'lib, butun halqani qoplaydi. Benzolning tuzilishini tavsiflashda tarixiy yondashuvni hisobga olgan holda, fenolning strukturaviy formulasi boshqacha ko'rinishi mumkin. Aromatik uglevodorodlarning to'yinmaganligini ta'kidlash uchun uchta oddiy bog'lanish bilan almashinadigan oltita bog'lanishning uchtasi shartli ravishda ikki tomonlama hisoblanadi.

Gidroksiguruhdagi bog'lanishning qutblanishi
Eng oddiyida - benzol C 6 H 6 - elektron buluti simmetrikdir. Fenol formulasi bitta gidroksi guruhi bilan farq qiladi. Gidroksilning mavjudligi simmetriyani buzadi, bu moddaning xususiyatlarida aks etadi. Gidroksi guruhidagi kislorod va vodorod o'rtasidagi bog'lanish qutbli kovalent bog'lanishdir. Umumiy juft elektronning kislorod atomiga siljishi unda manfiy (qisman) zaryad paydo bo'lishiga olib keladi. Vodorod elektronni yo'qotadi va qisman "+" zaryad oladi. Bundan tashqari, O-H guruhidagi kislorod ikkita yolg'iz elektron juftiga ega. Ulardan biri aromatik yadroning elektron buluti tomonidan tortiladi. Shu sababli, bog'lanish yanada qutblanadi va metallar bilan osonroq almashtiriladi. Modellar fenol molekulasining assimetrik tabiati haqida tushuncha beradi.

Fenoldagi atomlarning o'zaro ta'sirining xususiyatlari
Fenol molekulasidagi aromatik yadroning yagona elektron buluti gidroksil guruhi bilan o'zaro ta'sir qiladi. Konjugatsiya deb ataladigan hodisa ro'y beradi, buning natijasida gidroksi guruhi kislorod atomining elektron juftligi benzol halqasi tizimiga tortiladi. Salbiy zaryadning pasayishi O-H guruhidagi bog'lanishning yanada katta polarizatsiyasi bilan qoplanadi.
Aromatik yadrodagi elektron taqsimot tizimi ham o'zgaradi. U kislorod bilan bog'liq bo'lgan uglerodda kamayadi va orto pozitsiyalarida (2 va 6) joylashgan unga eng yaqin atomlarda ortadi. Juftlik ularda "-" zaryadining to'planishiga olib keladi. Zichlikning keyingi siljishi uning meta pozitsiyalardagi (3 va 5) atomlardan para holatidagi (4) uglerodga o'tishidir. Konjugatsiya va o'zaro ta'sirni o'rganish qulayligi uchun fenol formulasi odatda benzol halqasining atomlarini raqamlashni o'z ichiga oladi.

Fenolning kimyoviy xossalarini elektron tuzilishi asosida tushuntirish
Aromatik halqa va gidroksilning konjugatsiya jarayonlari ikkala zarrachaning va butun moddaning xususiyatlariga ta'sir qiladi. Masalan, orto va para pozitsiyalaridagi (2, 4, 6) atomlarning yuqori elektron zichligi fenolning aromatik halqasining C-H aloqalarini faolroq qiladi. Meta pozitsiyalarida (3 va 5) uglerod atomlarining manfiy zaryadi kamayadi. Orto va para pozitsiyalaridagi uglerod kimyoviy reaktsiyalarda elektrofil zarralar tomonidan hujumga uchraydi. Benzolning bromlanishi reaktsiyasida kuchli qizdirish va katalizator mavjudligi bilan o'zgarishlar sodir bo'ladi. Monogalogen hosilasi, bromobenzol hosil bo'ladi. Fenol formulasi moddaning aralashmani qizdirmasdan deyarli bir zumda brom bilan reaksiyaga kirishiga imkon beradi.
Aromatik halqa gidroksi guruhidagi bog'lanishning polaritesiga ta'sir qiladi va uni oshiradi. Vodorod atomi to'yingan spirtlarga nisbatan ko'proq harakatchan bo'ladi. Fenol ishqorlar bilan reaksiyaga kirishib, tuzlar - fenolatlar hosil qiladi. Etanol ishqorlar bilan reaksiyaga kirishmaydi, to'g'rirog'i, reaksiya mahsulotlari - etanolatlar parchalanadi. Kimyoviy jihatdan fenollar spirtlarga qaraganda kuchliroq kislotalardir.
Aromatik spirtlar sinfining vakillari
Fenol gomologining yalpi formulasi, krezol (metilfenol, gidroksitoluol) C 7 H 8 O. Tabiiy xom ashyo tarkibidagi modda ko'pincha fenol bilan birga keladi va antiseptik xususiyatlarga ham ega. Boshqa fenol gomologlari:
- Pirokatexol (1,2-gidroksibenzol). Kimyoviy formula - C 6 H 4 (OH) 2.
- Resorsinol (1,3-gidroksibenzol) - C 6 H 4 (OH) 2.
- Pirogallol (1,2,3-trigidroksibenzol) - C 6 H 3 (OH) 3.
- Naftol. Moddaning yalpi formulasi C 10 H 7 OH. U bo'yoqlar, dori-darmonlar va xushbo'y birikmalar ishlab chiqarishda qo'llaniladi.
- Timol (2-izopropil-5-metilfenol). Kimyoviy formula - C 6 H 3 CH 3 (OH) (C 3 H 7). U organik sintez va tibbiyot kimyosida qo'llaniladi.
- Vanillin, fenolik radikaldan tashqari, efir guruhi va aldegid qoldig'ini o'z ichiga oladi. Murakkabning yalpi formulasi C 8 H 8 O 3 dir. Vanillin sun'iy xushbo'y hid sifatida keng qo'llaniladi.
Fenolni aniqlash uchun reagent formulasi
Fenolni sifatli aniqlash brom yordamida amalga oshirilishi mumkin. Natijada tribromofenolning oq cho'kmasi hosil bo'ladi. Pirokatexol (1,2-gidroksibenzol) erigan temir xlorid ishtirokida yashil rangga aylanadi. Fenol bir xil reagent bilan kimyoviy reaksiyaga kirishadi va trifenolat hosil bo'ladi siyohrang. Rezorsinolga sifatli reaktsiya - temir xlorid ishtirokida quyuq binafsha rangning paydo bo'lishi. Asta-sekin eritmaning rangi qora rangga aylanadi. Fenol va uning ba'zi gomologlarini tanib olishga xizmat qiluvchi reaktiv formulasi FeCl 3 (temir (III) xlorid).

Gidroksibenzol, naftol, timol fenollardir. Moddalarning umumiy formulasi va tarkibi bu birikmalarning aromatik qatorga tegishli ekanligini aniqlash imkonini beradi. Ularning formulasida gidroksi guruhlari bevosita bog'langan C 6 H 5 fenil radikalini o'z ichiga olgan barcha organik moddalar o'ziga xos xususiyatlarga ega. Ular spirtlardan yaxshiroq ifodalangan kislotaliligi bilan farqlanadi. Benzol moddalariga nisbatan fenollar faolroq kimyoviy birikmalardir.
Molekuladagi OH guruhlari soniga qarab bir, ikki va uch atomli fenollar farqlanadi (1-rasm).
Guruch. 1. BIR-, BI- VA TRIXATIK FENOLLAR
Molekuladagi quyuqlashgan aromatik halqalar soniga ko'ra ular (2-rasm) fenollarning o'ziga (bitta aromatik halqa - benzol hosilalari), naftollarga (2 kondensatsiyalangan halqa - naftalin hosilalari), antranollarga (3 kondensatsiyalangan halqa - antrasen) bo'linadi. hosilalari) va fenantrollar (2-rasm).
Guruch. 2. MONO- VA KO'P YADRLI FENOLLAR
Spirtli ichimliklar nomenklaturasi.
Fenollar uchun tarixan rivojlangan arzimas nomlar keng qo'llaniladi. Almashtirilgan mononuklear fenollarning nomlari ham prefikslardan foydalanadi orto-,meta- Va juft -, aromatik birikmalar nomenklaturasida ishlatiladi. Murakkabroq birikmalar uchun aromatik halqalarning bir qismi bo'lgan atomlar raqamlanadi va raqamli indekslar yordamida o'rinbosarlarning holati ko'rsatiladi (3-rasm).
Guruch. 3. FENOLLARNING NOMENKLATURASI. O'rnini bosuvchi guruhlar va mos keladigan raqamli indekslar ravshanlik uchun turli ranglarda ta'kidlangan.
Fenollarning kimyoviy xossalari.
Fenol molekulasida birlashgan benzol halqasi va OH guruhi bir-biriga ta'sir qilib, bir-birining reaktivligini sezilarli darajada oshiradi. Fenil guruhi OH guruhidagi kislorod atomidan bir juft elektronni yutadi (4-rasm). Natijada, ushbu guruhning H atomida qisman musbat zaryad kuchayadi (d+ belgisi bilan ko'rsatilgan), O-H aloqasining qutbliligi oshadi, bu esa ushbu guruhning kislotali xususiyatlarining oshishida namoyon bo'ladi. Shunday qilib, spirtli ichimliklar bilan solishtirganda, fenollar kuchli kislotalardir. Fenil guruhiga o'tadigan qisman manfiy zaryad (d- bilan belgilanadi) pozitsiyalarda to'plangan. orto- Va juft-(OH guruhiga nisbatan). Ushbu reaktsiya nuqtalariga elektrofil (elektronni yaxshi ko'radigan) reagentlar deb ataladigan elektromanfiy markazlarga tortiladigan reagentlar hujum qilishi mumkin.
Guruch. 4. FENOLDA ELEKTRON ZIZGICHLIGINI TARQATISH
Natijada, fenollar uchun ikki turdagi transformatsiyalar mumkin: OH guruhidagi vodorod atomini almashtirish va H-atomobenzol halqasini almashtirish. Benzol halqasiga tortilgan O atomining bir juft elektroni C-O bog'ining kuchini oshiradi, shuning uchun spirtlarga xos bo'lgan ushbu bog'lanishning yorilishi bilan sodir bo'ladigan reaktsiyalar fenollarga xos emas.
1. Vodorod atomining OH guruhidagi almashinish reaksiyalari. Fenollarga ishqorlar taʼsirida fenolatlar hosil boʻladi (5A-rasm), spirtlar bilan katalitik oʻzaro taʼsir qilish natijasida efirlar hosil boʻladi (5B-rasm), karboksilik kislotalarning angidridlari yoki kislota xloridlari bilan reaksiyaga kirishishi natijasida efirlar hosil boʻladi (5-rasm). 5C). Ammiak bilan o'zaro ta'sirlashganda (harorat va bosimning oshishi) OH guruhi NH 2 bilan almashtiriladi, anilin hosil bo'ladi (5D-rasm), qaytaruvchi reagentlar fenolni benzolga aylantiradi (5E-rasm).
2. Benzol halqasida vodorod atomlarining almashinish reaksiyalari.
Fenolni galogenlash, nitrlash, sulfonlash va alkillash jarayonida elektron zichligi oshgan markazlarga hujum qilinadi (4-rasm), ya'ni. almashtirish asosan yilda amalga oshiriladi orto- Va juft- pozitsiyalari (6-rasm).
Chuqurroq reaksiya bilan benzol halqasida ikki va uchta vodorod atomlari almashtiriladi.
Fenollarning aldegidlar va ketonlar bilan kondensatsiya reaktsiyalari alohida ahamiyatga ega, asosan, bu oson va yumshoq sharoitlarda (40-50 ° C da, katalizatorlar ishtirokidagi suvli muhit) uglerod atomi bilan sodir bo'ladi; metilen guruhining shakli CH 2 yoki almashtirilgan metilen guruhi (CHR yoki CR 2) ikkita fenol molekulasi orasiga kiritiladi. Ko'pincha bunday kondensatsiya polimer mahsulotlarining shakllanishiga olib keladi (7-rasm).
Preparatning tarkibiy qismi sifatida ikki atomli fenol (bisfenol A savdo nomi, 7-rasm) ishlatiladi. epoksi qatronlar. Fenolning formaldegid bilan kondensatsiyasi keng qo'llaniladigan fenol-formaldegid smolalarini (fenoplastlar) ishlab chiqarishga asoslanadi.
Fenollarni olish usullari.
Fenollar ko'mir smolasidan, shuningdek, qo'ng'ir ko'mir va yog'och (qatron) piroliz mahsulotlaridan ajratiladi. Fenol C6H5OH ni ishlab chiqarishning sanoat usulining o'zi aromatik uglevodorod kumenini (izopropilbenzol) atmosfera kislorodi bilan oksidlanishiga, so'ngra H2SO4 bilan suyultirilgan gidroperoksidning parchalanishiga asoslangan (8A-rasm). Reaktsiya yuqori mahsuldorlik bilan davom etadi va jozibador bo'lib, u bir vaqtning o'zida ikkita texnik qimmatli mahsulot - fenol va asetonni olish imkonini beradi. Boshqa usul - galogenli benzollarning katalitik gidrolizi (8B-rasm).
Guruch. 8. FENOL OLISH USULLARI
Fenollarni qo'llash.
Fenol eritmasi dezinfektsiyalovchi (karbol kislotasi) sifatida ishlatiladi. Ikki atomli fenollar - pirokatexol, rezorsinol (3-rasm), shuningdek gidroxinon ( juft- dihidroksibenzol) antiseptiklar (antibakterial dezinfektsiyalash vositalari) sifatida ishlatiladi, teri va mo'yna uchun bronzlash vositalariga qo'shiladi, moylash moylari va kauchuk uchun stabilizatorlar, shuningdek, fotomateriallarni qayta ishlash uchun va analitik kimyoda reagentlar sifatida ishlatiladi.
Fenollar alohida birikmalar shaklida cheklangan darajada qo'llaniladi, lekin ularning turli hosilalari keng qo'llaniladi. Fenollar turli xil polimer mahsulotlari - fenolik qatronlar (7-rasm), poliamidlar, poliepoksidlar ishlab chiqarish uchun boshlang'ich birikmalar bo'lib xizmat qiladi. Fenollar asosida, ko'p dorilar masalan, aspirin, salol, fenolftalein, shuningdek, bo'yoqlar, parfyumeriya, polimerlar uchun plastifikatorlar va o'simliklarni himoya qilish vositalari.
Mixail Levitskiy
Fenollar.
1. Ta'rif. Tasniflash.
2. Nomenklatura va izomeriya. Asosiy vakillari
3. Kvitansiya
4. Fizik xossalari
6. Ilova. Inson salomatligiga ta'siri.
Fenollar bir yoki bir nechta gidroksil guruhi bo'lgan benzol hosilalari.
Tasniflash.
qarab gidroksi guruhlar soni bo'yicha fenollar atomligiga ko'ra: bir, ikki va uch atomlilarga bo'linadi.
tomonidan moddalarning uchuvchanlik darajasi Ular odatda ikki guruhga bo'linadi - bug' bilan uchuvchi fenollar (fenol, krezollar, ksilenollar, guaiakol, timol) va uchuvchan bo'lmagan fenollar (rezorsin, pirokatexol, gidroxinon, pirogallol va boshqa ko'p atomli fenollar). Quyida biz alohida vakillarning tuzilishi va nomenklaturasini ko'rib chiqamiz.

Nomenklatura va izomeriya. Asosiy vakillari.
Birinchi vakil, qoida tariqasida, ahamiyatsiz nomenklatura, fenol (gidroksibenzol, eskirgan karbol kislotasi) bilan ataladi.
https://pandia.ru/text/78/359/images/image005_11.gif" width="409" height="104">
3,5-dimetilfenol 4-etilfenol
Arzimas nomlar ko'pincha turli darajadagi almashtirish fenollari uchun ishlatiladi.
Kvitansiya
1) Quruq ko'mir smola mahsulotlaridan, shuningdek, qo'ng'ir ko'mir va yog'och (qatron) piroliz mahsulotlaridan izolyatsiya qilish.
2) Benzolsulfon kislotasi orqali. Birinchidan, benzol konsentrlangan sulfat kislota bilan qizdirilgan holda ishlanadi
C6H6 + H2SO4 = C6H5SO3H + H2O
Olingan benzolsulfon kislotasi ishqor bilan birlashtiriladi
C6H5SO3H + 3NaOH = C6H5ONa + 2H2O + Na2SO3
Fenolatni kuchli kislota bilan davolashdan so'ng fenol olinadi.
3) Kumen usuli (aromatik uglevodorod kumenini (izopropilbenzol) atmosfera kislorodi bilan oksidlanishiga, keyin hosil bo'lgan gidroperoksidning H2SO4 bilan suyultirilgan parchalanishiga asoslangan). Reaktsiya yuqori rentabellik bilan davom etadi va jozibador bo'lib, u bir vaqtning o'zida ikkita texnik qimmatli mahsulotni - fenol va asetonni olish imkonini beradi (siz buni o'zingiz ko'rib chiqishingiz kerak).
Jismoniy xususiyatlar
Fenol rangsiz igna shaklidagi kristallar bo'lib, oksidlanish tufayli havoda pushti rangga aylanadi, natijada rangli mahsulotlar paydo bo'ladi. Ular o'ziga xos gouache hidiga ega. Suvda (100 g suvga 6 g), ishqor eritmalarida, spirtda, benzolda, asetonda eriydi.
Fenol bilan ishlashda siz xavfsizlik choralariga rioya qilishingiz kerak: kaput ostida ishlang, shaxsiy himoya vositalaridan foydalaning, chunki u teriga tegsa, kuyishga olib keladi.
Fenollarning kimyoviy xossalari
Fenol molekulasining tuzilishi
Fenol molekulasida birlashgan benzol halqasi va OH guruhi bir-biriga ta'sir qilib, bir-birining reaktivligini o'zaro oshiradi. Fenil guruhi OH guruhidagi kislorod atomidan bir juft elektronni yutadi.
https://pandia.ru/text/78/359/images/image007_10.gif" width="348" height="62">
Spirtlar bilan katalitik o'zaro ta'sir efirlarga olib keladi va angidridlar yoki karboksilik kislotalarning kislotali xloridlari bilan reaksiyaga kirishishi natijasida efirlar hosil bo'ladi. Bu oxirgi ma'ruzada o'rganilgan spirtlarning reaktsiyalariga o'xshash reaktsiyalardir (ular o-alkillanish va o-atsillanish deb ham ataladi).


2. OH guruhining abstraktsiyasini o'z ichiga olgan reaksiyalar
Ammiak bilan o'zaro ta'sirlashganda (bilan ko'tarilgan harorat va bosim), OH guruhi NH2 bilan almashtiriladi va anilin hosil bo'ladi.

3. Benzol halqasida vodorod atomlarining almashinish reaksiyalari
(elektrofil almashtirish reaktsiyalari) .
OH guruhi I turdagi faollashtiruvchi orientatsiya agentidir. Shuning uchun fenolni galogenlash, nitrlash, sulfonlash va alkillash jarayonida elektron zichligi oshgan markazlarga hujum qilinadi, ya'ni almashtirish asosan o'zida sodir bo'ladi. orto- Va juft- qoidalari. Bunday reaktsiyalar benzol halqasida orientatsiya qoidalariga bag'ishlangan ma'ruzada batafsil o'rganildi.
Fenollarning reaksiyalari halogenlar bilan katalizatorlarsiz tez davom eting.

o-xloro- va p-xlorfenol
Fenol harakatda kons.HNO3 2,4,6-trinitrofenolga (pikrik kislota) aylanadi. Nitrlash oksidlanish bilan kechadi, shuning uchun mahsulot unumdorligi past bo'ladi.

Mononitrofenollar fenolni suyultirilgan nitrat kislota bilan (xona haroratida) nitrlash natijasida hosil bo'ladi.

o-nitro- va p-nitrofenol
Fenol oson sulfonlanadi konsentrlanganH2 SO 4, 15-20 ° S haroratda asosan o-izomer, 100 ° C da esa p-izomer olinadi.

o-fenol- va p-fenolsulfonik kislotalar
Fenollar ham oson ta'sir qiladi alkillanish va asillanish yadroga.

Eng hayratlanarli reaktsiyalardan biri fenollarni ftalik angidrid bilan sulfat kislota ishtirokida qizdirishdir, bu esa fenolftaleinlar deb ataladigan triarilmetilen bo'yoqlarini ishlab chiqarishga olib keladi.
Aspirin" href="/text/category/aspirin/" rel="bookmark">aspirin. Natriy va kaliy fenolatlar CO2 bilan reaksiyaga kirishadi. 125°C haroratda fenolkarboksilik kislotaning o - izomeri olinadi, u asillanadi. OH guruhida aspirin hosil qiladi.

Fenollarning yana ikkita sifatli reaktsiyasini ta'kidlash kerak:
1) Fenollarning brom bilan reaksiyasi: u juda tez davom etadi va monobrominatsiya bosqichida uni to'xtatish juda qiyin. Natijada 2.4.6-tribromofenol hosil bo'ladi - oq cho'kma.

Reaksiya suvda fenolni aniqlash uchun ishlatiladi: loyqalik suvda juda past fenol miqdori bilan ham seziladi (1: 100 000).
2) Fe(III) tuzlari bilan reaksiyasi. Reaksiya binafsha rangga ega bo'lgan temir fenolatlar komplekslarini shakllantirishga asoslangan.
https://pandia.ru/text/78/359/images/image023_0.gif" width="204" height="49">
Nikel katalizatori ishtirokida vodorod bilan gidrogenlash aromatik halqaga ta'sir qiladi, uni kamaytiradi.

4. Fenollarning oksidlanishi
Fenollar oksidlovchi moddalar ta'siriga sezgir. Xrom kislota taʼsirida fenol va gidroxinon p-benzoxinongacha, pirokatexol esa o-benzoxinongacha oksidlanadi. Fenol metaderivativlarini oksidlanish ancha qiyin.
Bezatish materiallari va ish" href="/text/category/otdelochnie_materiali_i_raboti/" rel="bookmark">pardozlash materiallari, lak-bo'yoq mahsulotlari, dekorativ kosmetika va hatto bolalar o'yinchoqlari xavfsizlik talablarini e'tiborsiz qoldirishi va zaharli moddalarni qabul qilib bo'lmaydigan darajada yuqori miqdorda ishlab chiqarishi mumkin. fenollar va ularning hosilalari kabi.
Shuning uchun hushyor bo'lish va zaharlanishning dastlabki belgilarida chora ko'rish kerak. Esingizda bo'lsin, agar siz yaqinda sotib olingan narsaning yoqimsiz hididan xavotirda bo'lsangiz, mebel sotib olganingizdan yoki yaqinda ta'mirlanganingizdan keyin sog'lig'ingiz yomonlashgandek tuyulsa, barcha kerakli tadqiqotlarni o'tkazadigan va atrof-muhitni muhofaza qilish bo'yicha mutaxassisni chaqirgan ma'qul. o'z sog'lig'i va yaqinlarining sog'lig'i uchun qo'rqib, tashvish va shubhada qolishdan ko'ra kerakli tavsiyalarni bering.
Ikkinchisida jahon urushi fenol Uchinchi Reyx kontslagerlarida o'ldirish uchun ishlatilgan.
Fenol ham jiddiy ta'sir qiladi muhit: ifloslanmagan yoki ozgina ifloslangan daryo suvlarida fenollarning miqdori odatda 20 mkg/dm3 dan oshmaydi. Ortiqcha tabiiy fon suv ifloslanishining belgisi sifatida xizmat qilishi mumkin. Fenollar bilan ifloslangan tabiiy suvlarda ularning miqdori litriga o'nlab va hatto yuzlab mikrogrammga yetishi mumkin. Rossiya uchun suvda fenollarning ruxsat etilgan maksimal kontsentratsiyasi 0,001 mg / dm3 ni tashkil qiladi.
Fenol uchun suv tahlili tabiiy va uchun muhimdir Chiqindi suvlari. Suv oqimlarining sanoat oqava suvlari bilan ifloslanishiga shubha mavjud bo'lsa, suvni fenol tarkibiga tekshirish kerak.
Fenollar beqaror birikmalar bo'lib, biokimyoviy va kimyoviy oksidlanishga uchraydi. Ko'p atomli fenollar asosan kimyoviy oksidlanish natijasida yo'q qilinadi.
Biroq, fenol aralashmalari bo'lgan suvni xlor bilan tozalashda juda xavfli organik birikmalar paydo bo'lishi mumkin. toksik moddalar - dioksinlar.
Er usti suvlarida fenollar kontsentratsiyasi mavsumiy o'zgarishlarga duchor bo'ladi. Yozda fenollar miqdori kamayadi (harorat oshishi bilan parchalanish tezligi oshadi). Fenolik suvlarning suv omborlari va suv oqimlariga chiqishi ularning umumiy sanitariya holatini keskin yomonlashtiradi, tirik organizmlarga nafaqat zaharliligi bilan, balki ozuqa moddalari va erigan gazlar (kislorod, karbonat angidrid) rejimining sezilarli o'zgarishi bilan ham ta'sir qiladi. Tarkibida fenollar boʻlgan suvni xlorlash natijasida xlorfenollarning turgʻun birikmalari hosil boʻladi, ularning eng kichik izlari (0,1 mkg/dm3) suvga oʻziga xos taʼm beradi.
Fenollar- aromatik uglevodorodlarning hosilalari, ular tarkibida benzol halqasi bilan bog'langan bir yoki bir nechta gidroksil guruhi bo'lishi mumkin.
Fenollar nima deyiladi?
IUPAC qoidalariga ko'ra, nomi " fenol" Atomlarning raqamlanishi gidroksi guruhiga bevosita bog'langan atomdan kelib chiqadi (agar u katta bo'lsa) va o'rinbosarlar eng past raqamni olishlari uchun raqamlangan.
Vakil - fenol - C 6 H 5 OH:
Fenolning tuzilishi.
Kislorod atomining tashqi sathida yakka elektron jufti mavjud bo'lib, u halqa tizimiga tortiladi (+M effekti). U-guruhlar). Natijada 2 ta ta'sir paydo bo'lishi mumkin:
1) benzol halqasining elektron zichligini orto- va para- pozitsiyalarga oshirish. Asosan, bu ta'sir elektrofil almashtirish reaktsiyalarida o'zini namoyon qiladi.
2) kislorod atomidagi zichlik kamayadi, buning natijasida bog'lanish U zaiflashadi va yirtilib ketishi mumkin. Ta'siri to'yingan spirtlarga nisbatan fenolning kislotaliligi oshishi bilan bog'liq.
Mono-almashtirilgan hosilalar fenol(kresol) 3 ta struktura izomerida bo'lishi mumkin:

Fenollarning fizik xossalari.
Fenollar xona haroratida kristall moddalardir. Sovuq suvda yomon eriydi, lekin issiq suvda va ishqorlarning suvli eritmalarida yaxshi eriydi. Ular o'ziga xos hidga ega. Vodorod aloqalarining hosil bo'lishi tufayli ular yuqori qaynash va erish nuqtasiga ega.
Fenollarni tayyorlash.
1. Galobenzollardan. Xlorbenzol va natriy gidroksidi bosim ostida qizdirilganda, natriy fenolat olinadi, u kislota bilan reaksiyaga kirishib, fenolga aylanadi:
2. Sanoat usuli: kumenning havoda katalitik oksidlanishi natijasida fenol va aseton hosil bo‘ladi:

3. Aromatik sulfokislotalardan ishqorlar bilan qo'shilish yo'li bilan. Ko'pincha ko'p atomli fenollarni hosil qilish uchun amalga oshiriladigan reaktsiya:

Fenollarning kimyoviy xossalari.
R Kislorod atomining -orbitali aromatik halqali yagona tizim hosil qiladi. Shuning uchun kislorod atomida elektron zichligi kamayadi, benzol halqasida esa ortadi. Aloqa polaritesi U ortadi va gidroksil guruhining vodorodi ko'proq reaktiv bo'ladi va ishqorlar ta'sirida ham osonlikcha metall atomi bilan almashtirilishi mumkin.
Fenollarning kislotaliligi spirtnikiga qaraganda yuqori, shuning uchun quyidagi reaksiyalarni amalga oshirish mumkin:
Ammo fenol zaif kislotadir. Agar uning tuzlari orqali karbonat angidrid yoki oltingugurt dioksidi o'tkazilsa, fenol ajralib chiqadi, bu karbonat va oltingugurt kislotalarining kuchliroq kislotalar ekanligini isbotlaydi:
Fenollarning kislotali xossalari halqaga I turdagi o‘rinbosarlarning kiritilishi bilan zaiflashadi va II tipning kiritilishi bilan kuchayadi.
2) Efirlarning hosil bo'lishi. Jarayon kislota xloridlari ta'sirida sodir bo'ladi:
3) Elektrofil almashtirish reaksiyasi. Chunki U-guruh birinchi turdagi o'rinbosar bo'lsa, keyin orto- va para-pozitsiyalarda benzol halqasining reaktivligi ortadi. Fenolga bromli suv ta'sirida cho'kma paydo bo'ladi - bu fenolga sifatli reaktsiya:

4) Fenollarni nitrlash. Reaksiya nitratlash aralashmasi bilan amalga oshiriladi, natijada pikrik kislota hosil bo'ladi:

5) Fenollarning polikondensatlanishi. Reaktsiya katalizatorlar ta'sirida sodir bo'ladi:

6) Fenollarning oksidlanishi. Fenollar atmosfera kislorodi bilan oson oksidlanadi:

7) Fenolga sifatli reaksiya - temir xlorid eritmasining ta'siri va binafsha rangli kompleks hosil bo'lishi.
Fenollarni qo'llash.
Fenollar fenol-formaldegid smolalari, sintetik tolalar, bo'yoqlar va dori vositalari, dezinfektsiyalash vositalari ishlab chiqarishda qo'llaniladi. Pikrik kislota portlovchi moddalar sifatida ishlatiladi.
Ularni tabiatda topish mumkin, ammo insonga eng ko'p ma'lum bo'lganlar sun'iy ravishda olinganlardir. Ular hozir kimyo sanoati, qurilish, plastmassa ishlab chiqarish va hatto tibbiyotda keng qo'llaniladi. Uning yuqori toksik xususiyatlari, birikmalarining barqarorligi va teri va nafas olish tizimi orqali inson tanasiga kirish qobiliyati tufayli fenol bilan zaharlanish ko'pincha sodir bo'ladi. Shuning uchun bu modda o'ta xavfli zaharli birikma sifatida tasniflangan va undan foydalanish qat'iy tartibga solingan.
Fenollar nima
Tabiiy va sun'iy ravishda ishlab chiqarilgan. Tabiiy fenollar foydali bo'lishi mumkin - ular antioksidantlar, polifenollar bo'lib, ba'zi o'simliklarni odamlar uchun shifo beradi. Sintetik fenollar esa zaharli moddalardir. Agar ular teri bilan aloqa qilsalar, ular inson tanasiga kirsa, ular kuchli zaharlanishga olib keladi; Uchuvchi aromatik uglevodorodlar deb tasniflangan bu murakkab birikmalar 40 darajadan biroz yuqori haroratda allaqachon gaz holatiga aylanadi. Lekin ichida normal sharoitlar shaffof kristalli modda o'ziga xos hid bilan.
Fenolning ta'rifi maktabda organik kimyo kursida o'rganiladi. Shu bilan birga, uning tarkibi, molekulyar tuzilishi va haqida gapiradi zararli xususiyatlar. Ko'pchilik tabiatda katta rol o'ynaydigan ushbu guruhning tabiiy moddalari haqida hech narsa bilishmaydi. Fenolni qanday tavsiflash mumkin? Buning tarkibi kimyoviy birikma juda oddiy: benzoin guruhi molekulasi, vodorod va kislorod.
Fenollarning turlari
Ushbu moddalar ko'plab o'simliklarda mavjud. Ular poyalariga rang beradi, gullarni hidlaydi yoki zararkunandalarni qaytaradi. Bundan tashqari, zaharli bo'lgan sintetik birikmalar ham mavjud. Bu moddalarga quyidagilar kiradi:
- Tabiiy fenolik birikmalar kapsaitsin, evgenol, flavonoidlar, ligninlar va boshqalar.
- Eng mashhur va zaharli fenol karbol kislotasidir.
- Butilfenol, xlorofenol birikmalari.
- Kreozot, Lizol va boshqalar.
Lekin asosan oddiy odamlar Faqat ikkita nom ma'lum: va fenolning o'zi.
Bu birikmalarning xossalari
Bu kimyoviy moddalar nafaqat zaharli. Ular odamlar tomonidan biron bir sababga ko'ra ishlatiladi. Fenolning qanday fazilatlarga ega ekanligini aniqlash uchun kompozitsiya juda muhimdir. Uglerod, vodorod va kislorodning birikmasi unga o'ziga xos xususiyatlarni beradi. Shuning uchun fenol odamlar tomonidan juda keng qo'llaniladi. Ushbu ulanishning xususiyatlari quyidagilardan iborat:

Fenollarning tabiatdagi roli
Ushbu moddalar ko'plab o'simliklarda mavjud. Ular o'zlarining rangi va hidini yaratishda ishtirok etadilar. Kapsaitsin achchiq qalampirga o'zining achchiqligini beradi. Antosiyaninlar va flavonoidlar daraxtlarning qobig'ini bo'yashadi, ketol yoki evgenol esa gullarning xushbo'yligini ta'minlaydi. Ba'zi o'simliklarda polifenollar, bir nechta fenol molekulalari birikmasidan hosil bo'lgan moddalar mavjud. Ular inson salomatligi uchun foydalidir. Polifenollarga ligninlar, flavonoidlar va boshqalar kiradi. Ushbu moddalar zaytun moyi, mevalar, yong'oqlar, choy, shokolad va boshqa oziq-ovqatlarda mavjud. Ulardan ba'zilari qarishga qarshi ta'sirga ega va tanani saraton kasalligidan himoya qiladi. Ammo zaharli birikmalar ham mavjud: taninlar, urushiol, karbol kislotasi.
Fenollarning odamlarga zarari
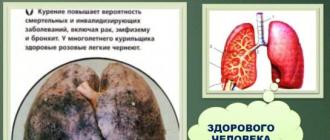
Ushbu modda va uning barcha hosilalari teri va o'pka orqali tanaga osongina kirib boradi. Qonda fenol boshqa moddalar bilan birikmalar hosil qiladi va yanada zaharli bo'ladi. Tanadagi kontsentratsiyasi qanchalik yuqori bo'lsa, shunchalik ko'p zarar etkazishi mumkin. Fenol asab va yurak-qon tomir tizimlarining faoliyatini buzadi, jigar va buyraklarga ta'sir qiladi. Qizil qon hujayralarini yo'q qiladi, allergik reaktsiyalar va oshqozon yarasini keltirib chiqaradi.
Ko'pincha fenol bilan zaharlanish sodir bo'ladi ichimlik suvi, shuningdek, uning hosilalari qurilish, bo'yoq yoki mebel ishlab chiqarishda ishlatilgan xonalarda havo orqali.
Uning birikmalari nafas olayotganda, nazofarenkning tirnash xususiyati va hatto o'pka shishi paydo bo'ladi. Agar fenol teriga tushsa, kuchli kimyoviy kuyish paydo bo'ladi, shundan so'ng yomon davolanadigan yaralar paydo bo'ladi. Va agar inson terisining to'rtdan biridan ko'prog'i ta'sirlangan bo'lsa, bu uning o'limiga olib keladi. Fenolning kichik dozalarini tasodifiy yutish, masalan, ifloslangan suv orqali, oshqozon yarasi, harakatni muvofiqlashtirishning buzilishi, bepushtlik, yurak etishmovchiligi, qon ketishi va saratonga olib kelishi mumkin. Katta dozalar darhol o'limga olib keladi.

Fenollar qayerda ishlatiladi?
Ushbu moddaning kashf etilishidan keyin uning havodagi rangini o'zgartirish qobiliyati aniqlandi. Bu sifat bo'yoqlar ishlab chiqarish uchun ishlatilgan. Ammo keyin uning boshqa xususiyatlari aniqlandi. Fenol moddasi inson faoliyatida keng qo'llaniladi:

Tibbiyotda qo'llanilishi
Fenolning bakteritsid xususiyatlari aniqlangach, u tibbiyotda keng qo'llanila boshlandi. Asosan binolarni, asboblarni va hatto xodimlarning qo'llarini dezinfektsiyalash uchun. Bundan tashqari, fenollar ba'zi mashhur dorilarning asosiy komponentlari hisoblanadi: aspirin, purgen, sil kasalligini davolash uchun preparatlar, qo'ziqorin kasalliklari va turli antiseptiklar, masalan, xeroform.
Endi fenol ko'pincha kosmetologiyada terini chuqur tozalash uchun ishlatiladi. Bunday holda, uning epidermisning yuqori qatlamini yoqish xususiyati ishlatiladi.

Dezinfektsiyalash uchun fenoldan foydalanish
Tashqi foydalanish uchun malham va eritma shaklida maxsus preparat ham mavjud. Xonadagi narsalarni va sirtlarni, asboblarni va zig'irni dezinfeksiya qilish uchun ishlatiladi. Shifokor nazorati ostida fenol kondiloma, pyoderma, impetigo, follikulit, yiringli yaralar va boshqa teri kasalliklarini davolash uchun ishlatiladi. Eritma bilan birgalikda binolarni dezinfektsiyalash va kirlarni namlash uchun ishlatiladi. Agar siz uni kerosin yoki turpentin bilan aralashtirsangiz, u zararkunandalarga qarshi kurash xususiyatlarini oladi.

Terining katta joylari, shuningdek, oziq-ovqat mahsulotlarini tayyorlash va saqlash uchun mo'ljallangan xonalar fenol bilan ishlov berilmasligi kerak.
Fenol bilan qanday zaharlanish mumkin?
Kattalar uchun ushbu moddaning o'limga olib keladigan dozasi 1 g dan, bola uchun esa 0,05 g dan fenol bilan zaharlanish quyidagi sabablarga ko'ra yuzaga kelishi mumkin.
- zaharli moddalar bilan ishlashda xavfsizlik choralariga rioya qilmaslik;
- baxtsiz hodisa yuz berganda;
- dori-darmonlarning dozalariga rioya qilmaslik;
- o'yinchoqlar yoki idish-tovoqlar kabi fenol o'z ichiga olgan plastik mahsulotlardan foydalanganda;
- agar uy kimyoviy moddalari noto'g'ri saqlangan bo'lsa.
O'tkir holatlarda ular darhol ko'rinadi va odamga yordam ko'rsatilishi mumkin. Ammo fenolning xavfli tomoni shundaki, kichik dozalarni qabul qilganda uni sezmaslik mumkin. Shuning uchun, agar biror kishi foydalanilgan xonada yashasa Bezatish materiallari, bo'yoq mahsulotlari yoki fenol chiqaradigan mebel, surunkali zaharlanish paydo bo'ladi.

Zaharlanish belgilari
Muammoni o'z vaqtida aniqlash juda muhimdir. Bu davolanishni o'z vaqtida boshlash va o'limning oldini olishga yordam beradi. Asosiy alomatlar boshqa har qanday zaharlanish bilan bir xil: ko'ngil aynishi, qusish, uyquchanlik, bosh aylanishi. Lekin ham bor xarakterli xususiyatlar, bu orqali odam fenol bilan zaharlanganligini bilib olishingiz mumkin:
- og'izdan xarakterli hid;
- hushidan ketish;
- tana haroratining keskin pasayishi;
- kengaygan o'quvchilar;
- rangparlik;
- nafas qisilishi;
- sovuq ter;
- yurak tezligi va qon bosimining pasayishi;
- qorin og'rig'i;
- qonli diareya;
- lablardagi oq dog'lar.
Shuningdek, surunkali zaharlanish belgilarini bilishingiz kerak. Kichik dozalar tanaga kirganda, buning kuchli belgilari yo'q. Ammo fenol salomatlikni buzadi. Surunkali zaharlanishning belgilari:
- tez-tez migren, bosh og'rig'i;
- ko'ngil aynishi;
- dermatit va allergik reaktsiyalar;
- uyqusizlik;
- ichak kasalliklari;
- kuchli charchoq;
- asabiylashish.
Zaharlanishda birinchi yordam va davolash
Jabrlanuvchiga birinchi yordam ko'rsatilishi va imkon qadar tezroq shifokorga olib borilishi kerak. Fenol bilan aloqa qilgandan keyin darhol ko'rish kerak bo'lgan choralar uning tanaga kirish joyiga bog'liq:
- Agar modda teriga tushsa, ko'p miqdorda suv bilan yuvib tashlang, kuyishlarni malham yoki yog 'bilan davolash qilmang;
- Agar fenol og'iz bo'shlig'ining shilliq qavatiga tushsa, yuving va hech narsani yutmang.
- Agar u oshqozonga tushsa, sorbentni iching, masalan, ko'mir, "Polisorb", shilliq qavatning kuyishini oldini olish uchun oshqozonni yuvish tavsiya etilmaydi.
Tibbiy muassasada zaharlanishni davolash murakkab va uzoq davom etadi. O'pkaning ventilyatsiyasi, detoksifikatsiya terapiyasi o'tkaziladi, antidot qo'llaniladi - kaltsiy glyukonat, sorbentlar, antibiotiklar, yurak preparatlari qo'llaniladi,
Fenollardan foydalanishda xavfsizlik qoidalari
Barcha mamlakatlarda sanitariya-epidemiologiya me'yorlari bino ichidagi havoda fenol kontsentratsiyasining ruxsat etilgan maksimal darajasini belgilab berdi. Xavfsiz doz 1 kg odam vazniga 0,6 mg ni tashkil qiladi. Ammo bu standartlar fenolning bunday konsentratsiyasi tanaga muntazam ravishda kirib borishi bilan ham, u asta-sekin to'planib, sog'likka jiddiy zarar etkazishi mumkinligini hisobga olmaydi. Ushbu modda havoga plastmassa buyumlar, bo'yoqlar, mebellar, qurilish va pardozlash materiallari, kosmetika mahsulotlaridan chiqarilishi mumkin. Shuning uchun siz sotib olgan mahsulotlarning tarkibini diqqat bilan kuzatib borishingiz kerak va agar biror narsadan yoqimsiz shirin hidni sezsangiz, undan xalos bo'lish yaxshiroqdir. Fenolni dezinfektsiyalash uchun ishlatganda, eritmalar uchun dozalash va saqlash qoidalariga qat'iy rioya qilish kerak.